
Resistin egenskaper, struktur, funksjoner
De motstand, Også kjent som fettvevsspesifikk sekretorisk faktor (ADSF), det er et peptidhormon rikt på cystein. Navnet skyldes den positive korrelasjonen (motstanden) som den presenterer for insulinets virkning. Det er et cytokin som har 10 til 11 cysteinrester.
Det ble oppdaget i 2001 i fettceller (fettvev) hos mus og i immun- og epitelceller fra mennesker, hunder, griser, rotter og flere primatarter..
Artikkelindeks
- 1 Generelle egenskaper
- 1.1 Hos mus
- 1.2 Hos mennesker
- 2 Synonymi
- 3 Oppdagelse
- 3.1 FIZZ3
- 3.2 ADSF
- 3.3 Resistin
- 4 Strukturer
- 5 funksjoner
- 6 Sykdommer
- 7 Referanser
Generelle egenskaper
Resistin er en del av en familie av resistintype-molekyler (Resistin-like molekyler, RELM-er). Alle medlemmer av RELM-familien presenterer en N-terminal sekvens, som presenterer sekresjonssignalet som er mellom 28 og 44 rester.
De har en variabel sentral region eller sone, med en karboksyl-terminal ende, av et domene som varierer mellom 57 og ca. 60 rester, høyt konserverte eller konserverte og rikelig med cystein.
Dette proteinet er funnet hos flere pattedyr. Mest oppmerksomhet er rettet mot resistin utskilt av mus og er tilstede hos mennesker. Disse to proteinene har 53 til 60% likhet (homologier) i deres aminosyresekvenser..
Hos mus
Hos disse pattedyrene er hovedkilden til resistin fettceller eller hvitt fettvev.
Resistin hos mus er rik på 11 kDa cystein. Genet for dette proteinet ligger på det åttende (8) kromosomet. Den syntetiseres som en 114 aminosyreforløper. De har også en 20 aminosyresignalsekvens og et modent segment på 94 aminosyrer..
Strukturelt har resistin hos mus fem disulfidbindinger og flere β-svinger. Den kan danne komplekser av to identiske molekyler (homodimerer) eller danne proteiner med kvartære strukturer (multimerer) av forskjellige størrelser takket være disulfid- og ikke-disulfidbindinger.
Hos mennesker
Humant resistin er preget av å være, som hos mus eller andre dyr, et peptidprotein rikt på cystein, bare hos mennesker er det 12 kDa, med en moden sekvens på 112 aminosyrer.
Genet for dette proteinet finnes på kromosom 19. Kilden til resistin hos mennesker er makrofagceller (celler i immunsystemet) og epitelvev. Sirkulerer i blodet som et dimerprotein med 92 aminosyrer bundet av disulfidbindinger.

Synonymi
Resistin er kjent med flere navn, inkludert: cysteinrikt sekretert protein FIZZ3 (cysteinrikt sekretert protein FIZZ3), fettvevspesifikk sekretorisk faktor (ADSF), fettvevspesifikk sekretorisk faktor (ADSF), proteinrikt på C / EBP -epsilonregulert myeloid-spesifikt utskilt cysteinrikt protein, utskilt cysteinrikt protein A12-alfa-lignende 2 (Cysteinrikt utskilt protein A12-alfa-lignende 2), RSTN, XCP1, RETN1, MGC126603 og MGC126609.
Oppdagelse
Dette proteinet er relativt nytt for det vitenskapelige samfunnet. Det ble oppdaget uavhengig av tre grupper av forskere i begynnelsen av dette århundret, som ga det forskjellige navn: FIZZ3, ADSF og resistin..
FIZZ3
Den ble oppdaget i 2000, i betent lungevev. Tre gener fra mus og to homologe gener fra mennesker assosiert med produksjonen av dette proteinet ble identifisert og beskrevet..
ADSF
Protein oppdaget i 2001, takket være identifikasjonen av en sekresjonsfaktor rik på cystin (Ser / Cys) (ADSF) spesifikk for hvitt lipidvev (adipositter).
Dette proteinet ble tildelt en viktig rolle i prosessen med å differensiere fra multipotente celler til modne adipositter (adipogenese).
Motstand
Også i 2001 beskrev en gruppe forskere det samme proteinrike cystinet i det modne lipidvevet hos mus, som de kalte resistin på grunn av dets motstand mot insulin..
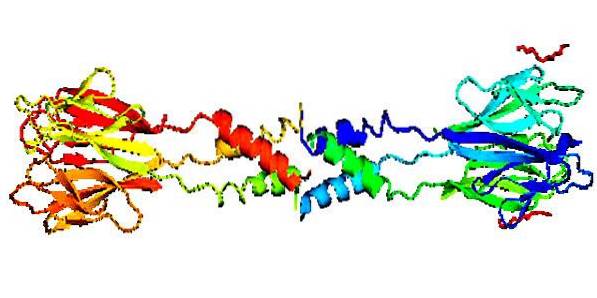
Strukturer
Strukturelt er det kjent at dette proteinet består av et laminært formet front- eller hodeområde, og et spiralformet bakområde (hale) som danner oligomerer med forskjellige molekylvekter, avhengig av om det er menneske eller av en annen opprinnelse..
Den har en sentral region med 11 rester av Ser / Cys (Serine / Cystein) og et område som også er rikt på Ser / Cys hvis sekvens er CX11CX8CXCX3CX10CXCXCX9CCX3-6, hvor C er Ser / Cys og X er hvilken som helst aminosyre.
Den har en strukturell sammensetning som anses som uvanlig, siden den er dannet av flere underenheter forbundet med ikke-kovalente interaksjoner, det vil si at de ikke bruker elektroner, men spredte elektromagnetiske variasjoner for å utgjøre deres struktur..
Funksjoner
Funksjonene til resistin, til dags dato, er gjenstand for omfattende vitenskapelig debatt. Blant de mest relevante funnene av de biologiske effektene hos mennesker og mus er:
- Flere vev hos mennesker og mus reagerer på resistin, inkludert lever-, muskel-, hjerte-, immun- og fettceller.
- Hyperresistinemiske mus (dvs. med forhøyede nivåer av resistin) opplever nedsatt glukose selvregulering (homeostase).
- Resistin reduserer insulinstimulert glukoseopptak i hjertemuskelceller.
- I immunceller (makrofager) hos mennesker induserer resistin produksjonen av proteiner som koordinerer immunsystemets respons (inflammatoriske cytokiner)
Sykdommer
Hos mennesker antas dette proteinet å bidra fysiologisk til insulinresistens ved diabetes mellitus..
Rollen den spiller i fedme er fortsatt ukjent, selv om det er funnet at det er en sammenheng mellom økt fettvev og resistinnivå, det vil si at fedme øker konsentrasjonen av resistin i kroppen. Det har også vist seg å være ansvarlig for høye nivåer av dårlig kolesterol i blodet.
Resistin modulerer molekylære veier i inflammatoriske og autoimmune patologier. Det forårsaker direkte funksjonell endring av endotel, noe som igjen fører til herding av arteriene, også kjent som ateroschlorosis.
Resistin fungerer som en indikator på sykdom og til og med som et prediktivt klinisk verktøy for hjerte- og karsykdommer. Det er involvert i produksjonen av blodkar (angiogenese), trombose, astma, alkoholfri fettleversykdom, kronisk nyresykdom, blant andre.
Referanser
- DC Juan, L.S. Kan, C.C. Huang, S.S. Chen, L.T. Ho, L.C. Au (2003). Produksjon og karakterisering av bioaktivt rekombinant resistin i Escherichia coli. Journal of Biotechnology.
- Menneskelig motstand. Pospec. Gjenopprettet fra prospecbio.com.
- S. Abramson. Resistim. Gjenopprettet fra collab.its.virginia.edu.
- G. Wolf (2004), Insulinresistens og fedme: resistin, et hormon utskilt av fettvev. Ernæringsanmeldelser.
- M. Rodríguez Pérez (2014), Studie av de biologiske funksjonene til S-Resistin. Rapport presentert for University of Castilla-La Mancha, for å søke om tittelen doktor i biokjemi. 191.
- A. Souki, N.J. Arráiz-Rodríguez, C. Prieto-Fuenmayor, ... C. Cano-Ponce (2018), Grunnleggende aspekter i fedme. Barranquilla, Colombia: Simón Bolívar University Editions. 44 s.
- Md.S. Jamaluddin, S.M. Weakley, Q. Yao og C. Chen (2012). Resistin: funksjonelle roller og terapeutiske hensyn for hjerte- og karsykdommer. British Journal of Pharmacology.
- Jeg motsto. Gjenopprettet fra en.wikipedia.org.
- D.R. Schwartz, M.A. Lazar (2011). Menneskelig resistin: Funnet i oversettelse fra mus til mann. Trender innen endokrinologi og metabolisme.



Ingen har kommentert denne artikkelen ennå.