
Silisiumhistorie, egenskaper, struktur, oppnåelse, bruk
De silisium Det er et ikke-metallisk og samtidig metalloid element som er representert av det kjemiske symbolet Si. Det er en halvleder, som er en viktig del av datamaskiner, kalkulatorer, mobiltelefoner, solceller, dioder osv. Det er praktisk talt hovedkomponenten som har tillatt etableringen av den digitale tidsalderen.
Silisium har alltid vært tilstede i kvarts og silikater, begge mineraler utgjør ca 28% av massen av hele jordskorpen. Det er dermed det nest mest utbredte elementet på jordens overflate, og vidstrakten til ørkenene og strendene gir et perspektiv på hvor rikelig den er..

Silisium tilhører gruppe 14 i det periodiske systemet, det samme som karbon, under det. Det er derfor dette elementet betraktes som en tetravalent metalloid; Den har fire valenselektroner, og i teorien kan den miste dem alle for å danne kationen Si4+.
En eiendom den deler med kull er dens evne til å knytte seg sammen; det vil si atomene deres er kovalent bundet for å definere molekylære kjeder. Likeledes kan silisium danne sine egne “hydrokarboner”, kalt silaner..
De dominerende forbindelsene av silisium i naturen er de berømte silikatene. I sin rene form kan den fremstå som et monokrystallinsk, polykrystallinsk eller amorft fast stoff. Det er relativt inert solid, så det representerer ikke betydelige risikoer.
Artikkelindeks
- 1 Historie
- 1.1 Silisiumsteinen
- 1.2 Isolasjon
- 1.3 Krystallinsk silisium
- 2 Fysiske og kjemiske egenskaper
- 2.1 Fysisk utseende
- 2.2 Molarmasse
- 2.3 Atomnummer (Z)
- 2.4 Smeltepunkt
- 2.5 Kokepunkt
- 2.6 Tetthet
- 2.7 Fusjonsvarme
- 2.8 Fordampningsvarme
- 2,9 Molar varmekapasitet
- 2.10 Elektronegativitet
- 2.11 Ioniseringsenergier
- 2.12 Atomeradius
- 2.13 Varmeledningsevne
- 2.14 Elektrisk motstand
- 2.15 Mohs hardhet
- 2.16 Sammenkjøring
- 2.17 oksidasjonstall
- 2.18 Reaktivitet
- 3 Struktur og elektronisk konfigurasjon
- 3.1 Kovalent karakter
- 3.2 Elektrisk ledningsevne
- 3.3 Amorf silisium
- 4 Hvor å finne og skaffe
- 4.1 -Reduksjon av silika
- 5 isotoper
- 6 Risiko
- 7 bruksområder
- 7.1 Byggebransjen
- 7.2 Glass og keramikk
- 7.3 Legeringer
- 7.4 Tørkemidler
- 7.5 Elektronisk industri
- 7.6 Silikonpolymerer
- 8 Referanser
Historie
Silisiumstein
Silisium er kanskje et av elementene som har hatt størst innflytelse i menneskehetens historie.
Dette elementet er hovedpersonen i steinalderen, og også i den digitale tidsalderen. Opprinnelsen dateres tilbake til da sivilisasjoner en gang jobbet med kvarts og laget sine egne briller; og for øyeblikket er det hovedkomponenten i datamaskiner, bærbare datamaskiner og smarttelefoner.
Silisium har praktisk talt vært steinen til to tydelig definerte epoker i vår historie.
Isolering
Siden silisium er så rikelig, et navn født av flintstein, må det ha inneholdt et ekstremt rikt element i jordskorpen; dette var den rette mistanken til Antoine Lavoisier, som i 1787 mislyktes i hans forsøk på å redusere den fra rusten.
Noe senere, i 1808, gjorde Humphry Davy sine egne forsøk og ga elementet fornavnet: 'silicium', som oversatt skulle bli som 'flintmetall'. Det vil si at silisium da ble ansett som et metall på grunn av manglende karakterisering..
I 1811 lyktes de franske kjemikerne Joseph L. Gay-Lussac og Louis Jacques Thénard for første gang å fremstille amorf silisium. For dette reagerte de silisiumtetrafluoridet med metallisk kalium. Imidlertid renset eller karakteriserte de ikke det erholdte produktet, så de konkluderte ikke med at det var det nye elementet silisium.
Først i 1823 fikk den svenske kjemikeren Jacob Berzelius et amorft silisium med tilstrekkelig renhet til å gjenkjenne det som silisium; navn gitt i 1817 av den skotske kjemikeren Thomas Thomson når han vurderte det som et ikke-metallisk element. Berzelius utførte reaksjonen mellom kaliumfluorsilikat og smeltet kalium for å produsere dette silisiumet.
Krystallinsk silisium
Krystallinsk silisium ble først fremstilt i 1854 av den franske kjemikeren Henry Deville. For å oppnå dette utførte Deville en elektrolyse av en blanding av aluminium og natriumklorider, og oppnådde således silisiumkrystaller dekket av et lag aluminiumsilicid, som han eliminerte (tilsynelatende) ved å vaske dem med vann..
Fysiske og kjemiske egenskaper
Fysisk utseende

Silisium i sin rene eller elementære form består av et gråaktig eller blå-svart fast stoff (øvre bilde), som selv om det ikke er metall, har blanke ansikter som om det virkelig var.
Det er et hardt, men sprøtt fast stoff, som også har en skjellende overflate hvis den består av polykrystaller. Amorft silisium ser derimot ut som et mørkebrunt pulverformig fast stoff. Takket være dette er det enkelt å identifisere og skille en type silisium (krystallinsk eller polykrystallinsk) fra en annen (amorf).
Molarmasse
28,085 g / mol
Atomnummer (Z)
14 (14Ja)
Smeltepunkt
1414 ºC
Kokepunkt
3265 ºC
Tetthet
-Ved romtemperatur: 2,33 g / ml
-Rett ved smeltepunktet: 2,57 g / ml
Merk at flytende silisium er tettere enn fast silisium; som betyr at dets krystaller vil flyte på en flytende fase av det samme, som det skjer med isvannsystemet. Forklaringen skyldes det faktum at det interatomiske rommet mellom Si-atomene i deres krystall er større (mindre tett) enn det tilsvarende i væsken (mer tett).
Fusjonsvarme
50,21 kJ / mol
Fordampningsvarme
383 kJ / mol
Molar varmekapasitet
19,789 J / (mol K)
Elektronegativitet
1,90 på Pauling-skalaen
Ioniseringsenergier
-Først: 786,5 kJ / mol
-Andre: 1577,1 kJ / mol
-Tredje: 3231,6 kJ / mol
Atomic radio
111 pm (målt på deres respektive diamantkrystaller)
Termisk ledningsevne
149 W / (m K)
Elektrisk motstand
2.3 103 Ω · m ved 20 ºC
Mohs hardhet
6.5
Sammenkobling
Silisiumatomer har evnen til å danne enkle Si-Si-bindinger, som til slutt definerer en kjede (Si-Si-Si ...).
Denne egenskapen manifesteres også av karbon og svovel; imidlertid sp hybridiseringer3 silisium er mer mangelfull sammenlignet med de to andre elementene, og i tillegg er deres 3p-orbitaler mer diffuse, så overlappingen av sp-orbitalene3 resultatet er svakere.
Den gjennomsnittlige energien til Si-Si og C-C kovalente bindinger er henholdsvis 226 kJ / mol og 356 kJ / mol. Derfor er Si-Si-obligasjonene svakere. På grunn av dette er ikke silisium hjørnesteinen i livet (og heller ikke svovel). Faktisk er det lengste kjedet eller skjelettet som silisium kan danne vanligvis fireleddet (Si4).
Oksidasjonsnumre
Silisium kan ha et av følgende oksidasjonsnummer, forutsatt at hver av dem eksisterer ioner med deres respektive ladninger: -4 (Si4-), -3 (Ja3-), -2 (Jato-), -1 (Ja-), +1 (Ja+), +2 (Jato+), +3 (Ja3+) og +4 (Ja4+). Av alle er -4 og +4 de viktigste.
For eksempel antas -4 i silisider (MgtoJa eller Mgtoto+Ja4-); mens +4 tilsvarer silika (SiOto eller hvis4+ELLERtoto-).
Reaktivitet
Silisium er helt uoppløselig i vann, så vel som sterke syrer eller baser. Imidlertid oppløses den i en konsentrert blanding av salpetersyre og flussyre (HNO)3-HF). På samme måte oppløses den i en varm alkalisk løsning, med følgende kjemiske reaksjon:
Si (s) + 2NaOH (aq) + HtoO (l) => NatoJa3(aq) + 2Hto(g)
Natriummetasilikatsaltet, NatoJa3, Det dannes også når silisium oppløses i smeltet natriumkarbonat:
Si (s) + NatoCO3(l) => NatoJa3(l) + C (s)
Ved romtemperatur reagerer den ikke i det hele tatt med oksygen, ikke engang ved 900 ºC, når et beskyttende glasslegem av SiO begynner å danneto; og deretter, ved 1400 ºC, reagerer silisiumet med nitrogenet i luften for å danne en blanding av nitrider, SiN og Si3N4.
Silisium reagerer også ved høye temperaturer med metaller for å danne metallsilicider:
2Mg (s) + Si (s) => MgtoJa (r)
2Cu (s) + Si (s) => CutoJa (r)
Ved romtemperatur reagerer den eksplosivt og direkte med halogener (det er ikke noe SiO-lagto for å beskytte deg mot dette). For eksempel har vi reaksjonen av dannelse av SiF4:
Ja (r) + 2Fto(g) => SiF4(g)
Og selv om silisium er uoppløselig i vann, reagerer det rødvarmt med en dampstrøm:
Ja (r) + HtoO (g) => SiOto(s) + 2Hto(g)
Struktur og elektronisk konfigurasjon
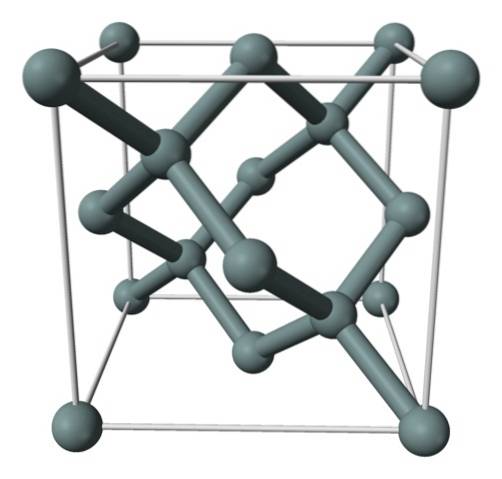
Bildet over viser den ansiktssentrerte kubiske strukturen (fcc), den samme som diamant, for silisiumkrystall. De gråaktig kulene tilsvarer Si-atomene, som, som man kan se, er kovalent bundet til hverandre; i tillegg har de tetraedermiljøer som er gjengitt langs krystallen.
Silisiumkrystallet er fcc fordi et Si-atom observeres plassert på hver av overflatene til kuben (6 × 1/2). På samme måte er det åtte Si-atomer i kubenes toppunkt (8 × 1/8), og fire ligger inne i den (de som viser en veldefinert tetraeder rundt seg, 4 × 1).
Når det er sagt, har hver enhetscelle totalt åtte silisiumatomer (3 + 1 + 4, tall angitt i avsnittet ovenfor); karakteristikk som hjelper til med å forklare dens høye hardhet og stivhet, siden rent silisium er en kovalent krystall som diamant.
Kovalent karakter
Denne kovalente karakteren skyldes at silisium, i likhet med karbon, har fire valenselektroner i henhold til den elektroniske konfigurasjonen:
[Ne] 3sto 3pto
For liming er de rene 3- og 2p-orbitalene ubrukelige. Det er derfor atomet skaper fire hybrid sp-orbitaler3, som den kan danne fire Si-Si kovalente bindinger med, og på denne måten fullføre valensoktet for de to silisiumatomer.
Silisiumkrystallet blir deretter visualisert som et kovalent, tredimensjonalt nettverk sammensatt av sammenkoblet tetraeder..
Imidlertid er dette nettverket ikke perfekt, siden det har mangler og korngrenser, som skiller og definerer en krystall fra en annen; og når slike krystaller er veldig små og mange, snakker vi om et polykrystallinsk fast stoff, identifisert av sin heterogene glans (ligner en sølvmosaikk eller skjellende overflate).
Elektrisk ledningsevne
Si-Si-bindingene, med sine velplasserte elektroner, er i prinsippet uenige med det som forventes av et metall: et hav av elektroner som "fukter" dets atomer; i det minste er dette så ved romtemperatur.
Når temperaturen øker, begynner imidlertid silisiumet å lede elektrisitet og oppfører seg derfor som et metall; det vil si at det er et halvleder metalloid element.
Amorf silisium
Silisiumtetraeder tar ikke alltid et strukturelt mønster, men kan ordnes på en uordnet måte; og til og med med silisiumatomer hvis hybridiseringer ikke ser ut til å være sp3 men spto, som bidrar til å ytterligere øke graden av uorden. Derfor snakker vi om et amorft og ikke-krystallinsk silisium.
I amorf silisium er det elektroniske ledige stillinger, der noen av atomene har en bane med et uparret elektron. Takket være dette kan dets faste stoff hydreres, noe som gir dannelse av hydrogenert amorft silisium; det vil si at den har Si-H-bindinger, som tetraedrene fullføres i uordnede og vilkårlige stillinger.
Denne delen avsluttes med å si at silisium kan presenteres i tre typer faste stoffer (uten å nevne renhetsgraden): krystallinsk, polykrystallinsk og amorf..
Hver av dem har sin egen produksjonsmetode eller prosess, samt applikasjoner og avveininger når de bestemmer seg for hvilke av de tre som skal brukes, og kjenner fordelene og ulempene..
Hvor å finne og skaffe

Silisium er det syvende mest utbredte elementet i universet, og det andre i jordskorpen, som også beriker jordens kappe med sin enorme familie av mineraler. Dette elementet forbinder ekstremt godt med oksygen og danner et bredt spekter av oksider; blant dem, silika, SOto, og silikater (med forskjellig kjemisk sammensetning).
Silika kan sees med det blotte øye i ørkener og strender, da sand hovedsakelig består av SiOto. I sin tur kan dette oksidet vises i noen få polymorfe, den vanligste er: kvarts, ametyst, agat, cristobalitt, tripoli, coesitt, stishovitt og tridymitt. I tillegg kan den finnes i amorfe faste stoffer som opaler og kiselgur..
Silikater er i mellomtiden enda rikere strukturelt og kjemisk. Noen av silikatmineralene inkluderer: asbest (hvit, brun og blåaktig), feltspat, leire, micas, oliviner, aluminosilikater, zeolitter, amfiboler og pyroksener.
Nesten alle bergarter er sammensatt av silisium og oksygen, med sine stabile Si-O-bindinger, og deres silisiumdioksyd og silikater blandet med metalloksider og uorganiske arter..
-Silisiumreduksjon
Problemet med å skaffe silisium er å bryte Si-O-bindingen, for hvilken spesielle ovner og en god reduksjonsstrategi er nødvendig. Råmaterialet for denne prosessen er silisiumdioksyd i form av kvarts, som tidligere er malt til det er et fint pulver..
Fra dette malte silisiumdioksyd kan enten amorft eller polykrystallinsk silisium fremstilles..
Amorf silisium
I liten skala, utført i et laboratorium og med passende tiltak, blandes silisiumdioksyd med magnesiumpulver i en digel og forbrennes i fravær av luft. Følgende reaksjon finner da sted:
Jato(s) + Mg (s) => 2MgO (s) + Si (s)
Magnesium og dets oksid fjernes med en fortynnet saltsyreoppløsning. Deretter blir det gjenværende faste stoffet behandlet med flussyre, slik at SiO reagerer ferdigto i overkant; ellers favoriserer overskuddet av magnesium dannelsen av dets respektive silisid, MgtoJa, uønsket forbindelse for prosessen.
SiOto blir den flyktige gassen SiF4, som utvinnes for andre kjemiske synteser. Til slutt tørkes den amorfe silisiummassen under en strøm av hydrogengass..
En annen lignende metode for å oppnå amorf silisium er å bruke den samme SiF4 tidligere produsert, eller SiCl4 (tidligere kjøpt). Dampene fra disse silisiumhalogenidene føres over flytende natrium i en inert atmosfære, slik at reduksjonen av gassen kan finne sted uten nærvær av oksygen:
SiCl4(g) + 4Na (l) => Si (s) + 4NaCl (l)
Interessant, amorft silisium brukes til å lage høyenergieffektive solcellepaneler.
Krystallinsk silisium
Med utgangspunkt i pulverisert silisiumdioksyd eller kvarts blir de ført til en lysbueovn, hvor de reagerer med koks. På denne måten er ikke reduksjonsmiddelet lenger et metall, men et karbonholdig materiale med høy renhet:
Jato(s) + 2C (s) => Si (s) + 2CO (g)
Reaksjonen produserer også silisiumkarbid, SiC, som nøytraliseres med et overskudd av SiOto (igjen er kvartset i overkant):
2SiC (s) + SiOto(s) => 3Si (s) + 2CO (g)
En annen metode for å fremstille krystallinsk silisium er å bruke aluminium som reduksjonsmiddel:
3JAto(s) + 4Al (l) => 3Si (s) + 2AltoELLER3(s)
Og med utgangspunkt i kaliumheksafluorurosilikatsaltet, Kto[SiF6] reageres det også med metallisk aluminium eller kalium for å produsere det samme produktet:
Kto[SiF6] (l) + 4Al (l) => 3Si (s) + 6KF (l) + 4AlF3(g)
Silisium oppløses umiddelbart i smeltet aluminium, og når systemet avkjøles, krystalliserer det første og skiller seg fra det andre; det vil si at det dannes silisiumkrystaller som ser gråaktig ut.
Polykrystallinsk silisium
I motsetning til de andre syntesene eller produksjonene, for å oppnå polykrystallinsk silisium begynner man med en silangassfase, SiH4. Denne gassen utsettes for en pyrolyse over 500 ° C, på en slik måte at det oppstår en termisk nedbrytning, og polykrystaller av silisium blir således fra sin første damp avsatt på en halvlederoverflate.
Følgende kjemiske ligning eksemplifiserer reaksjonen som finner sted:
Ja H4(g) => Si (s) + Hto(g)
Det burde åpenbart ikke være noe oksygen i kammeret, da det ville reagere med SiH4:
Ja H4(g) + 2Oto(g) => SiOto(s) + 2HtoO (g)
Og slik er forbrenningsreaksjonens spontanitet at den skjer raskt ved romtemperatur med minimal eksponering av silanen for luft..
En annen syntetisk vei for å produsere denne typen silisium starter fra krystallinsk silisium som råmateriale. De får det til å reagere med hydrogenklorid ved en temperatur rundt 300 ºC, slik at triklorsilan blir dannet:
Si (s) + 3 HC1 (g) => SiCl3H (g) + Hto(g)
Og SiCl3H reagerer ved 1100 ºC for å regenerere silisiumet, men nå polykrystallinsk:
4SiCl3H (g) => Si (s) + 3SiCl4(g) + 2Hto(g)
Bare se på ligningene for å få en ide om arbeidet og de strenge produksjonsparametrene som må vurderes..
Isotoper
Silisium forekommer naturlig og hovedsakelig som isotopen 28Ja, med en overflod på 92,23%.
I tillegg til dette er det to andre isotoper som er stabile og derfor ikke gjennomgår radioaktivt forfall: 29Ja, med en overflod på 4,67%; Y 30Ja, med en overflod på 3,10%. Å være så rikelig 28Ja, det er ikke overraskende at atomvekten til silisium er 28,084 u.
Silisium kan også finnes i flere radioisotoper, blant dem er 31Ja (t1/2= 2,62 timer) og 32Ja (t1/2= 153 år). Andre (22Ja - 44Hvis de har det t1/2 veldig kort eller kort (mindre enn hundredeler av et sekund).
Risiko
Rent silisium er et relativt inert stoff, så det akkumuleres vanligvis ikke i noe organ eller vev så lenge eksponeringen for det er lav. I pulverform kan det irritere øynene, forårsake rive eller rødhet, mens du berører det kan forårsake ubehag i huden, kløe og avskalling..
Når eksponeringen er veldig høy, kan silisium skade lungene; men uten ettervirkninger, med mindre mengden er tilstrekkelig til å forårsake kvelning. Dette er imidlertid ikke tilfelle med kvarts, som er forbundet med lungekreft og sykdommer som bronkitt og emfysem..
På samme måte er rent silisium veldig sjeldent i naturen, og dets forbindelser, så rikelig i jordskorpen, utgjør ingen risiko for miljøet..
Nå, med hensyn til organosilikon, kan disse være giftige; Men siden det er mange av dem, avhenger det av hvilken man vurderer, samt andre faktorer (reaktivitet, pH, virkningsmekanisme osv.).
applikasjoner
Anleggsbransjen
Silisiummineraler utgjør "steinen" som bygninger, hus eller monumenter er bygget med. For eksempel består sement, betong, stuk og ildfast murstein av faste blandinger basert på silikater. Fra denne tilnærmingen kan man forestille seg nytten av dette elementet i byer og i arkitektur..
Glass og keramikk
Krystaller som brukes i optiske enheter kan være laget av silisiumdioksyd, enten som isolatorer, prøveceller, spektrofotometre, piezoelektriske krystaller eller bare linser..
Når materialet tilberedes med flere tilsetningsstoffer, ender det med å transformere til et amorft fast stoff, kjent som glass; og fjell av sand er vanligvis kilden til silisiumdioksyd eller kvarts som er nødvendig for produksjonen. På den annen side produseres keramiske materialer og porselen med silikater.
Sammenflettede ideer, silisium er også til stede i håndverk og ornamentikk.
Legeringer
Silisiumatomer kan smelte sammen og være blandbare med en metallmatrise, noe som gjør det tilsetningsstoff for mange legeringer eller metaller; for eksempel stål for å lage magnetiske kjerner; bronse, for produksjon av telefonkabler; og aluminium, i produksjonen av aluminium-silisiumlegering beregnet på lette bildeler.
Derfor kan det ikke bare finnes i "steinen" til bygninger, men også i metallene i kolonnene deres..
Tørkemidler

Silisiumdioksyd, i gel eller amorf form, gjør det mulig å produsere faste stoffer som fungerer som tørkemidler ved å fange vannmolekylene som kommer inn i beholderen og holde det indre tørt..
Elektronisk industri

Silisiumlag med forskjellige tykkelser og farger er en del av databrikker, som med deres faste (krystallinske eller amorfe) integrerte kretser og solceller er designet.
Å være en halvleder, den inneholder atomer med mindre (Al, B, Ga) eller flere elektroner (P, As, Sb) for å transformere den til halvledere av typen s eller n, henholdsvis. Med kryssene mellom to silikoner, en n og den andre s, lysdioder produseres.
Silikonpolymerer
Det berømte silikonlimet består av en organisk polymer støttet av stabiliteten til kjedene til Si-O-Si-bindinger ... Hvis disse kjedene er veldig lange, korte eller tverrbundne, endres egenskapene til silikonpolymeren, så vel som deres endelige søknader..
Blant bruken, oppført nedenfor, kan følgende nevnes:
-Lim eller lim, ikke bare for å feste papir, men byggesteiner, gummi, glasspaneler, bergarter osv..
-Smøremidler i hydrauliske bremsesystemer
-Styrker maling og forbedrer fargenes lysstyrke og intensitet, samtidig som de lar dem tåle endringer i temperatur uten å sprekke eller spise bort.
-De brukes som vannavvisende spray, som holder noen overflater eller gjenstander tørre
-De gir personlige hygieneprodukter (tannkrem, sjampo, gel, barberkrem osv.) Følelsen av å være silkeaktig
-Beleggene beskytter de elektroniske komponentene til delikate enheter, for eksempel mikroprosessorer, mot varme og fuktighet
-Med silikonpolymerer er det laget flere av gummikulene som spretter så snart de faller på gulvet..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Silisium. Gjenopprettet fra: en.wikipedia.org
- MicroChemicals. (s.f.). Krystallografi av silisium. Gjenopprettet fra: microchemicals.com
- Lenntech B.V. (2019). Periodisk system: silisium. Gjenopprettet fra: lenntech.com
- Marques Miguel. (s.f.). Silisiumforekomst. Gjenopprettet fra: nautilus.fis.uc.pt
- Mer Hemant. (5. november 2017). Silisium. Gjenopprettet fra: hemantmore.org.in
- Pilgaard Michael. (22. august 2018). Silisium: Forekomst, isolasjon og syntese. Gjenopprettet fra: pilgaardelements.com
- Dr. Doug Stewart. (2019). Fakta om silisiumelement. Chemicool. Gjenopprettet fra: chemicool.com
- Christiana Honsberg og Stuart Bowden. (2019). En samling ressurser for solcellelæreren. PV-utdanning. Gjenopprettet fra: pveducation.org
- American Chemistry Council, Inc. (2019). Silikoner i hverdagen. Gjenopprettet fra: sehsc.americanchemistry.com



Ingen har kommentert denne artikkelen ennå.