
Karakteristiske topoisomeraser, funksjoner, typer og hemmere
De topoisomeraser De er en type isomeraseenzymer som endrer topologien til deoksyribonukleinsyre (DNA), og genererer både avvikling og vikling og supercoiling.
Disse enzymene har en spesifikk rolle i å avlaste torsjonsstress i DNA, slik at viktige prosesser som replikering, transkripsjon av DNA til messenger ribonukleinsyre (mRNA) og rekombinasjon av DNA kan forekomme..
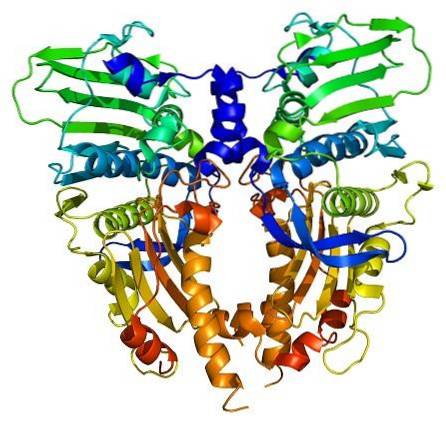
Topoisomerase-enzymer er tilstede i både eukaryote og prokaryote celler. Eksistensen ble spådd av forskerne Watson og Crick, når de vurderte begrensningene som DNA-strukturen presenterte for å gi tilgang til informasjonen (lagret i nukleotidsekvensen).
For å forstå funksjonene til topoisomeraser, må DNA anses å ha en stabil dobbel-helix-struktur, med strengene viklet over hverandre..
Disse lineære kjedene består av 2-deoksyribose bundet av 5'-3 'fosfodiesterbindinger, og nitrogenholdige baser inni dem, som trinnene i en vindeltrapp..
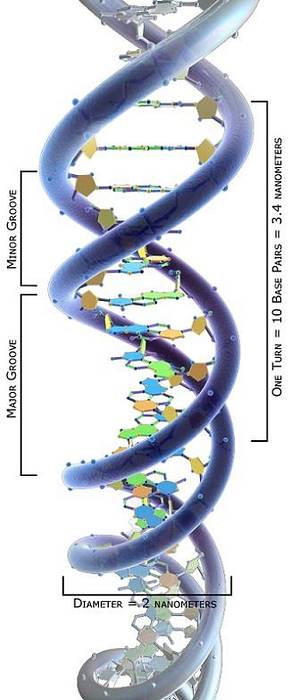
Den topologiske studien av DNA-molekyler har vist at de kan anta forskjellige konformasjoner avhengig av torsjonsstress: fra en avslappet tilstand til forskjellige viklingstilstander som tillater komprimering..
DNA-molekyler med forskjellige konformasjoner kalles topoisomerer. Dermed kan vi konkludere med at topoisomeraser I og II kan øke eller redusere torsjonsspenningen til DNA-molekyler, og danne deres forskjellige topoisomerer..
Blant de mulige DNA-topoisomerer er den mest vanlige konformasjonen superspolen, som er veldig kompakt. Imidlertid må DNA-dobbeltspiralen også vikles opp av topoisomeraser under forskjellige molekylære prosesser..
Artikkelindeks
- 1 Funksjoner
- 1.1 Generell virkningsmekanisme
- 1.2 Topoisomeraser og cellesyklusen
- 2 funksjoner
- 2.1 Kompakt lagring av genetisk materiale
- 2.2 Tilgang til genetisk informasjon
- 2.3 Regulering av genuttrykk
- 2.4 Spesialiteter ved topoisomerase II
- 3 typer topoisomeraser
- 3.1 -Topoisomeraser type I
- 3.2 -Topoisomeraser type II
- 3.3 -Menneskelige topoisomeraser
- 4 Topoisomerasehemmere
- 4.1 -Topoisomeraser som et mål for kjemisk angrep
- 4.2 -Typer av hemming
- 4.3 - Medikamenter for topoisomerasehemmere
- 5 Referanser
Kjennetegn
Generell virkningsmekanisme
Noen topoisomeraser kan bare slappe av negative superspoler av DNA, eller begge superspoler av DNA: positive og negative.
Hvis det sirkulære dobbeltstrengede DNA vikles ut på lengdeaksen og det skjer en venstrehånds sving (med klokken), sies det å være negativt supercoiled. Hvis svingen er med urviseren (mot urviseren), er den positivt overtrukket.

I utgangspunktet kan topoisomeraser:
-Gjør det lettere å passere en DNA-streng gjennom et kutt i motsatt streng (type I topoisomerase).
-Gjør det lettere å passere en komplett dobbel helix gjennom en spalting, eller gjennom en spaltning i en annen dobbel helix (type II topoisomerase).
Oppsummert virker topoisomeraser gjennom spalting av fosfodiesterbindinger, i en eller begge strengene som utgjør DNA. Deretter modifiserer de viklingstilstanden til strengene til en dobbel helix (topoisomerase I) eller to doble helices (topoisomerase II), for til slutt å binde eller knytte de spaltede endene igjen.
Topoisomeraser og cellesyklusen
Selv om topoisomerase I er et enzym som viser større aktivitet under S-fasen (DNA-syntese), anses det ikke å være avhengig av en fase av cellesyklusen.
Mens topoisomerase II-aktivitet er mest aktiv under den logaritmiske fasen av cellevekst og i celler av raskt voksende svulster.
Funksjoner
Endringen av gener som koder for topoisomeraser er dødelig for celler, noe som viser viktigheten av disse enzymene. Blant prosessene som topoisomeraser deltar i er:
Kompakt lagring av genetisk materiale
Topoisomeraser letter lagring av genetisk informasjon på en kompakt måte, på grunn av det faktum at de genererer coiling og supercoiling av DNA, slik at en stor mengde informasjon kan bli funnet i et relativt lite volum.
Tilgang til genetisk informasjon
Uten topoisomeraser og deres unike egenskaper ville tilgang til informasjonen som er lagret i DNA være umulig. Dette skyldes det faktum at topoisomeraser med jevne mellomrom frigjør torsjonsspenningen som genereres i DNA-dobbeltspiralen under avvikling i replikasjonsprosesser, transkripsjon og rekombinasjon..
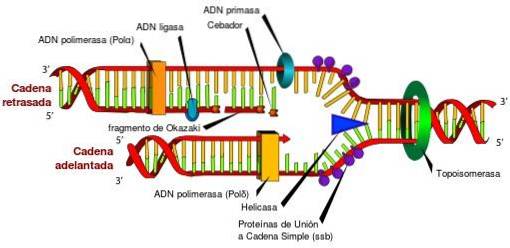
Hvis torsjonsstresset som genereres under disse prosessene ikke frigjøres, kan det oppstå et defekt genuttrykk, avbrudd av sirkulært DNA eller kromosom, til og med å produsere celledød.
Regulering av genuttrykk
Konformasjonsendringer (i den tredimensjonale strukturen) av DNA-molekylet utsetter spesifikke regioner for utsiden, som kan samhandle med DNA-bindende proteiner. Disse proteinene har en regulatorisk funksjon av genuttrykk (positiv eller negativ).
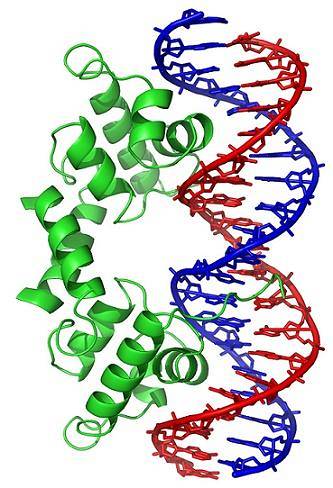
Dermed påvirker oppviklingstilstanden til DNA, generert av virkningen av topoisomeraser, reguleringen av genekspresjon.
Spesialiteter ved topoisomerase II
Topoisomerase II er nødvendig for montering av kromatider, kondensering og dekondensering av kromosomer og segregering av datter-DNA-molekyler under mitose..
Dette enzymet er også et strukturelt protein og en av hovedbestanddelene i cellekjernematrisen under interfase..
Typer topoisomeraser
Det er to hovedtyper av topoisomeraser, avhengig av om de er i stand til å spalte en eller to DNA-tråder.
-Type I topoisomeraser
Monomerisk
Type I topoisomeraser er monomerer som lindrer negative og positive superspoler, som produseres av hårnålsbevegelse under transkripsjon, og under genreplikasjon og rekombinasjonsprosesser..
Type I topoisomeraser kan deles inn i type 1A og type 1B. Sistnevnte er de som finnes hos mennesker, og er ansvarlige for å slappe av supercoiled DNA.
Tyrosin på sitt aktive sted
Topoisomerase 1B (Top1B) består av 765 aminosyrer delt inn i 4 spesifikke domener. Et av disse domenene har et meget bevart område som inneholder det tyrosinaktive området (Tyr7233). Alle topoisomeraser presenterer tyrosin på deres aktive sted med en grunnleggende rolle i hele den katalytiske prosessen.
Virkningsmekanismen
Tyrosin på det aktive stedet danner en kovalent binding med 3'-fosfatenden av DNA-strengen, kutter den og holder den bundet til enzymet, mens den fører en annen DNA-streng gjennom spaltingen.
Passasjen til den andre DNA-strengen gjennom den delte strengen oppnås takket være en konformasjonstransformasjon av enzymet, som produserer åpningen av DNA-dobbeltspiralen..
Deretter går topoisomerase I tilbake til sin opprinnelige konformasjon og binder de spaltede ender igjen. Dette skjer ved en prosess som er invers mot nedbrytningen av DNA-kjeden, ved det katalytiske stedet for enzymet. Til slutt frigjør topoisomerase DNA-strengen.
Graden av DNA-ligering er høyere enn hastigheten for eksisjon, og sikrer dermed molekylets stabilitet og integriteten til genomet..
Oppsummert katalyserer type I topoisomerase:
- Klyving av en streng.
- Passasjen til den andre strengen gjennom spaltingen.
- Ligering av de spaltede ender.
-Type II topoisomeraser
Dimeric
Type II topoisomeraser er dimere enzymer, som spalter begge DNA-strengene, og dermed slapper av superspolene som genereres under transkripsjon og andre cellulære prosesser.
Mg avhengig++ og ATP
Disse enzymene trenger magnesium (Mg++) og trenger også energien som kommer fra nedbrytningen av ATP-trifosfatbindingen, som de utnytter takket være en ATPase.
To aktive nettsteder med tyrosin
Humane topoisomeraser II ligner veldig på gjær (Saccharomyces cerevisiae), som består av to monomerer (underfragment A og B). Hver monomer har et ATPase-domene, og i et underfragment det aktive stedet tyrosin 782, til hvilket DNA kan binde. Dermed kan to DNA-tråder binde seg til topoisomerase II..
Virkningsmekanismen
Virkningsmekanismen til topoisomerase II er den samme som beskrevet for topoisomerase I, med tanke på at to DNA-tråder er delt og ikke bare en..
På det aktive stedet for topoisomerase II, et fragment av dobbeltspiralen av DNA, kalt "fragment G". Dette fragmentet blir skåret ut og holdt sammen til det aktive stedet ved kovalente bindinger..
Deretter tillater enzymet et annet DNA-fragment, kalt "T-fragment", å passere gjennom det spaltede fragmentet "G", takket være en konformasjonsendring av enzymet, som er avhengig av hydrolysen av ATP.
Topoisomerase II binder de to endene av "G-fragmentet" og gjenoppretter til slutt sin opprinnelige tilstand og frigjør "G" -fragmentet. DNA slapper deretter av torsjonsspenningen, slik at replikasjons- og transkripsjonsprosesser kan forekomme..
-Menneskelige topoisomeraser
Det menneskelige genomet har fem topoisomeraser: top1, top3α, top3β (av type I); og top2α, top2β (av type II). De mest relevante humane topoisomeraser er top1 (type IB topoisomerase) og 2α (type II topoisomerase).
Topoisomerasehemmere
-Topoisomeraser som et mål for kjemisk angrep
Fordi prosessene katalysert av topoisomeraser er nødvendige for cellers overlevelse, er disse enzymene et godt angrepsmål for å påvirke ondartede celler. Av denne grunn anses topoisomeraser som viktige i behandlingen av mange menneskelige sykdommer..
Legemidler som samhandler med topoisomeraser studeres for tiden mye som kjemoterapeutiske stoffer mot kreftceller (i forskjellige organer i kroppen) og patogene mikroorganismer..
-Typer hemming
Legemidler som hemmer topoisomeraseaktivitet kan:
- Sandwichet inn i DNA.
- Påvirke enzymet topoisomerase.
- Interkaleres i et molekyl nær enzymets aktive sted mens DNA-topoisomerase-komplekset er stabilisert.
Stabilisering av det forbigående komplekset som dannes ved binding av DNA til tyrosinet til enzymets katalytiske område, forhindrer binding av de spaltede fragmentene, noe som kan føre til celledød.
-Topoisomerase-hemmer medisiner
Forbindelser som hemmer topoisomeraser inkluderer følgende.
Antitumorantibiotika
Antibiotika brukes mot kreft, siden de forhindrer tumorceller i å vokse, vanligvis ved å forstyrre deres DNA. Disse kalles ofte antineoplastiske (kreft) antibiotika. Actinomycin D påvirker for eksempel topoisomerase II og brukes i Wilms-svulster hos barn og rabdomyosarkomer..
Antrasykliner
Antracykliner er blant antibiotikaene et av de mest effektive kreftmedisinene og med det bredeste spekteret. De brukes til å behandle lungekreft, eggstokker, livmor, mage, blære, bryst, leukemi og lymfomer. Det er kjent å påvirke topoisomerase II ved interkalering i DNA.
Den første antracyklinen isolert fra en aktinobakterie (Streptomyces peucetius) var daunorubicin. Senere ble doksorubicin syntetisert i laboratoriet, og for tiden brukes også epirubicin og idarubicin.
Antrakinoner
Antrakinoner eller antrasendioner er antracen-avledede forbindelser, i likhet med antracykliner, som påvirker topoisomerase II-aktivitet ved interkalering i DNA. De brukes mot metastatisk brystkreft, ikke-Hodgkins lymfom (NHL) og leukemi..
Disse stoffene ble funnet i pigmentene til noen insekter, planter (frangula, senna, rabarbra), lav og sopp; så vel som hoelitt, som er et naturlig mineral. Avhengig av dosen din, kan de være kreftfremkallende.
Blant disse forbindelsene har vi mitoksantron og dets analog, losoksantron. Disse forhindrer spredning av ondartede tumorceller og binder seg til DNA irreversibelt.
Epidofyllotoksiner
Podofyllotoksiner, som epidofyllotoksiner (VP-16) og teniposid (VM-26), danner et kompleks med topoisomerase II. De brukes blant annet mot lungekreft, testikkel, leukemi, lymfomer, eggstokkreft, brystkreft og ondartede intrakraniale svulster. De er isolert fra planter Podophyllum notatum Y P. peltatum.
Camptothecin-analoger
Kampoteciner er forbindelser som hemmer topoisomerase I, inkludert irinotekan, topotekan og diflomotekan..
Disse forbindelsene har blitt brukt mot tykktarms-, lunge- og brystkreft, og oppnås naturlig fra barken og bladene fra den arborale arten. Camptotheca acuminata av de kinesiske gesimseriene og Tibet.
Naturlig hemming
Strukturelle endringer av topoisomeraser I og II kan også forekomme helt naturlig. Dette kan skje under noen hendelser som påvirker den katalytiske prosessen.
Disse endringene inkluderer dannelsen av pyrimidindimerer, nitrogenbaseforskjell og andre hendelser forårsaket av oksidativt stress..
Referanser
- Anderson, H., & Roberge, M. (1992). DNA topoisomerase II: En gjennomgang av dens involvering i kromosomstruktur, DNA-replikasjon, transkripsjon og mitose. Cell Biology International Reports, 16 (8): 717-724. doi: 10.1016 / s0309-1651 (05) 80016-5
- Chhatriwala, H., Jafri, N., & Salgia, R. (2006). En gjennomgang av topoisomeraseinhibering i lungekreft. Kreftbiologi og terapi, 5 (12): 1600-1607. doi: 10.4161 / cbt.5.12.3546
- Ho, Y.-P., Au-Yeung, S. C. F., & To, K. K. W. (2003). Platinabaserte kreftmidler: Innovative designstrategier og biologiske perspektiver. Medisinske forskningsanmeldelser, 23 (5): 633-655. doi: 10.1002 / med.10038
- Li, T.-K., & Liu, L. F. (2001). Svulstcelledød indusert av topoisomerase-Targeting drugs. Årlig gjennomgang av farmakologi og toksikologi, 41 (1): 53-77. doi: 10.1146 / annurev.pharmtox.41.1.53
- Liu, L. F. (1994). DNA Topoisomerases: Topoisomerase-Targeting Drugs. Akademisk presse. s. 307
- Osheroff, N. og Bjornsti, M. (2001). DNA Topoisomerase. Enzymologi og narkotika. Bind II. Humana Press. s. 329.
- Rothenberg, M. L. (1997). Topoisomerase I-hemmere: Gjennomgang og oppdatering. Annals of Oncology, 8 (9), 837-855. doi: 10.1023 / a: 1008270717294
- Ryan B. (2009, 14. desember). Topoisomerase 1 og 2. [Videofil]. Gjenopprettet fra youtube.com



Ingen har kommentert denne artikkelen ennå.