
Voltammetri hva den består av, typer og applikasjoner
De voltammetri Det er en elektroanalytisk teknikk som bestemmer informasjon om en kjemisk art eller analyt fra de elektriske strømningene som genereres av variasjonen av et anvendt potensial. Det vil si at det anvendte potensialet E (V) og tiden (t) er de uavhengige variablene; mens gjeldende (A), den avhengige variabelen.
Den kjemiske arten må vanligvis være elektroaktiv. Hva betyr det? Det betyr at den må miste (oksidere) eller få (redusere) elektroner. For at reaksjonen skal starte, må arbeidselektroden levere det nødvendige potensialet teoretisk bestemt av Nernst-ligningen.
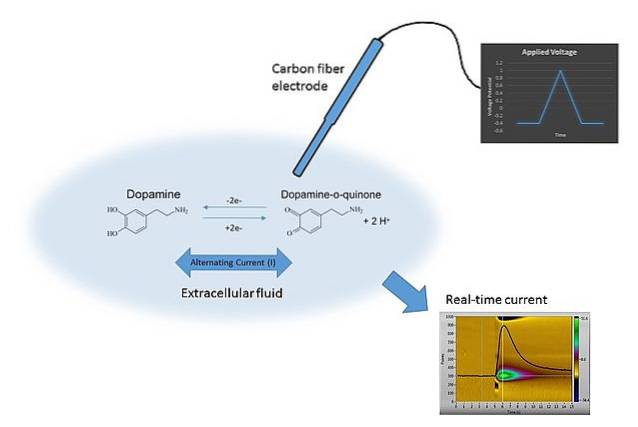
Et eksempel på voltammetri kan sees på bildet ovenfor. Elektroden i bildet er laget av karbonfibre, som er nedsenket i oppløsningsmediet. Dopamin oksyderer ikke og danner to karbonylgrupper C = O (høyre side av den kjemiske ligningen) med mindre riktig potensial blir brukt.
Dette oppnås ved å skanne E med forskjellige verdier, begrenset av mange faktorer som løsningen, ionene som er tilstede, den samme elektroden og dopamin..
Ved å variere E over tid oppnås to grafer: den første E v t (den blå trekanten), og den andre, responsen C vs t (gul). Dens former er karakteristiske for å bestemme dopamin under forholdene i eksperimentet..
Artikkelindeks
- 1 Hva er voltammetri??
- 1.1 Voltammetrisk bølge
- 1.2 Instrumentering
- 2 typer
- 2.1 Puls voltammetri
- 2.2 Redissolution voltammetry
- 3 applikasjoner
- 4 Referanser
Hva er voltammetri?
Voltammetri ble utviklet takket være oppfinnelsen av polarografiteknikken av Nobelprisvinneren i kjemi i 1922, Jaroslav Heyrovsky. I den fornyes og polariseres elektroden til kvikksølvfallet (EGM) kontinuerlig.
De analytiske manglene ved denne metoden på den tiden ble løst ved bruk og design av andre mikroelektroder. Disse varierer enormt i materiale, fra karbon, edle metaller, diamanter og polymerer, til design, skiver, sylindere, ark; og også på den måten de samhandler med løsningen: stasjonær eller roterende.
Alle disse detaljene er ment å favorisere polarisasjonen av elektroden, noe som forårsaker et forfall av den registrerte strømmen kjent som grensestrøm (i1). Dette er proporsjonalt med konsentrasjonen av analytten, og halve styrken E (E.1/2) for å nå halvparten av strømmen (i1/2) er karakteristisk for arten.
Deretter bestemmer du verdiene til E.1/2 på kurven der strømmen oppnådd med variasjonen av E, kalt voltamperogram, tilstedeværelsen av en analyt kan identifiseres. Det vil si at hver analyt, gitt vilkårene for eksperimentet, vil ha sin egen verdi av E.1/2.
Voltammetrisk bølge
I voltammetri jobber du med mange grafer. Den første av dem er E vs t-kurven, som gjør det mulig å følge opp de anvendte potensielle forskjellene som en funksjon av tiden.
Men samtidig registrerer den elektriske kretsen C-verdiene som produseres av analytten ved å miste eller få elektroner i nærheten av elektroden..
Fordi elektroden er polarisert, kan mindre analyt diffundere fra løsningen inn i den. For eksempel, hvis elektroden er positivt ladet, vil arten X- vil bli tiltrukket av det og vil gå mot det ved bare elektrostatisk tiltrekning.
Men X- Du er ikke alene: det er andre ioner tilstede i miljøet ditt. Noen kationer M+ de kan komme i veien for elektroden ved å omslutte den i "klynger" av positive ladninger; og på samme måte N anioner- kan sette seg fast rundt elektroden og forhindre X- Jeg kom til ham.
Summen av disse fysiske fenomenene fører til at strøm går tapt, og dette observeres i C vs E-kurven og dens form ligner den på en S, kalt sigmoidform. Denne kurven er kjent som en voltametrisk bølge..
Instrumentering
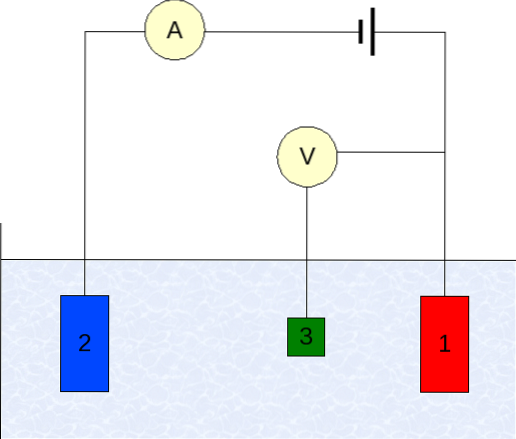
Instrumenteringen til voltammetri varierer avhengig av analyt, løsemiddel, type elektrode og applikasjon. Men de aller fleste er basert på et system som består av tre elektroder: en for arbeid (1), hjelpestøtte (2) og referanse (3)..
Den viktigste referanseelektroden som brukes er calomel-elektroden (ECS). Dette sammen med arbeidselektroden gjør det mulig å etablere en potensialforskjell AE, siden potensialet til referanseelektroden forblir konstant under målingene..
På den annen side har hjelpeelektroden ansvaret for å kontrollere ladningen som går til arbeidselektroden for å holde den innenfor akseptable E-verdier. Den uavhengige variabelen, den anvendte potensialforskjellen, er den som oppnås ved å legge til potensialene til arbeids- og referanseelektrodene..
Typer

Bildet over viser en E vs t-graf, også kalt en potensiell bølge for en lineær sveip voltammetri..
Man kan se at etter hvert som tiden går, øker potensialet. I sin tur genererer denne feien en responskurve eller voltamperogram C vs E hvis form vil være sigmoid. Det vil komme et punkt hvor uansett hvor mye E øker, vil det ikke være noen økning i strømmen.
Andre typer voltammetri kan utledes fra denne grafen. Hvordan? Endring av potensialbølgen E vs t gjennom plutselige potensielle pulser etter visse mønstre. Hvert mønster er assosiert med en type voltammetri, og omfatter sin egen teori og eksperimentelle forhold..
Puls voltammetri
I denne typen voltammetri kan blandinger av to eller flere analytter hvis E-verdier analyseres1/2 er veldig nær hverandre. Dermed en analyt med E1/2 på 0,04V kan identifiseres i selskap med en annen med en E.1/2 på 0,05V. Mens det er i lineær sveip voltammetri, må forskjellen være større enn 0,2V.
Derfor er det høyere følsomhet og lavere deteksjonsgrenser; dvs. analytter kan bestemmes ved svært lave konsentrasjoner.
Potensialbølger kan ha mønstre som ligner på trapper, skrå trapper og trekanter. Sistnevnte tilsvarer syklisk voltammetri (CV for akronym på engelsk, første bilde).
I CV påføres et potensial E i en retning, positivt eller negativt, og deretter, ved en viss verdi på E på tidspunktet t, blir det samme potensialet brukt igjen, men i motsatt retning. Når man studerer voltampogrammer som genereres, avslører maksimumene tilstedeværelsen av mellommenn i en kjemisk reaksjon.
Redissolution voltammetry
Dette kan være av anodisk eller katodisk type. Den består av elektrodeposisjonen til analytten på en kvikksølvelektrode. Hvis analytten er et metallion (for eksempel Cdto+), en amalgam vil danne seg; og hvis det er et anion, (som MoO4to-) et uoppløselig kvikksølvsalt.
Deretter påføres pulser av potensialer for å bestemme konsentrasjonen og identiteten til den elektroavsatte arten. Dermed blir amalgamet oppløst på nytt, som kvikksølvsalter.
applikasjoner
-Anodisk gjenoppløsnings voltammetri brukes til å bestemme konsentrasjonen av oppløste metaller i væske.
-Det gjør det mulig å studere kinetikken til redoks eller adsorpsjonsprosesser, spesielt når elektrodene modifiseres for å oppdage en spesifikk analyt..
-Dens teoretiske grunnlag har blitt brukt til produksjon av biosensorer. Med disse kan tilstedeværelsen og konsentrasjonen av biologiske molekyler, proteiner, fett, sukker osv. Bestemmes..
-Til slutt oppdager den deltakelse fra mellommenn i reaksjonsmekanismene.
Referanser
- González M. (22. november 2010). Voltammetri. Gjenopprettet fra: quimica.laguia2000.com
- Gómez-Biedma, S., Soria, E., & Vivó, M… (2002). Elektrokjemisk analyse. Journal of Biological Diagnosis, 51 (1), 18-27. Gjenopprettet fra scielo.isciii.es
- Kjemi og vitenskap. (18. juli 2011). Voltammetri. Gjenopprettet fra: laquimicaylaciencia.blogspot.com
- Quiroga A. (16. februar 2017). Syklisk voltammetri. Gjenopprettet fra: chem.libretexts.org
- Samuel P. Kounaves. (s.f.). Voltammetriske teknikker. [PDF]. Tufts University. Gjenopprettet fra: brown.edu
- Dag R. & Underwood A.. Kvantitativ analytisk kjemi (femte utg.). PEARSON Prentice Hall.



Ingen har kommentert denne artikkelen ennå.