
Boroksyd (B2O3) struktur, egenskaper og bruksområder
De boroksid eller borsyreanhydrid er en uorganisk forbindelse hvis kjemiske formel er BtoELLER3. Siden bor og oksygen er elementer i blokk p i det periodiske systemet, og enda flere hoder for deres respektive grupper, er ikke elektronegativitetsforskjellen mellom dem veldig høy; derfor er det å forvente at BtoELLER3 er kovalent i naturen.
BtoELLER3 Den fremstilles ved å oppløse boraks i konsentrert svovelsyre i en smelteovn og ved en temperatur på 750 ° C; termisk dehydrering av borsyre, B (OH)3, ved en temperatur på ca. 300 ° C; eller det kan også dannes som et reaksjonsprodukt av diboran (BtoH6) med oksygen.

Boroksid kan ha et halvt gjennomsiktig glassaktig eller krystallinsk utseende; sistnevnte ved sliping kan fås i pulverform (øvre bilde).
Selv om det kanskje ikke virker slik ved første øyekast, regnes det som BtoELLER3 som et av de mest komplekse uorganiske oksyder; ikke bare fra et strukturelt synspunkt, men også på grunn av de variable egenskapene ervervet av glass og keramikk som dette er lagt til i matrisen.
Artikkelindeks
- 1 Struktur av boroksid
- 1.1 BO3-enhet
- 1.2 Krystallstruktur
- 1.3 Glasslegemestruktur
- 2 eiendommer
- 2.1 Fysisk utseende
- 2.2 Molekylær masse
- 2.3 Smak
- 2.4 Tetthet
- 2.5 Smeltepunkt
- 2.6 Kokepunkt
- 2.7 Stabilitet
- 3 Nomenklatur
- 4 bruksområder
- 4.1 Syntese av bortrihalogenider
- 4.2 Insektmiddel
- 4.3 Løsemiddel av metalloksider: dannelse av glass, keramikk og borlegeringer
- 4.4 Bindemiddel
- 5 Referanser
Boroksydstruktur
BO-enhet3
BtoELLER3 er et kovalent fast stoff, så i teorien er det ingen B-ioner i strukturen3+ ei heller Oto-, men B-O lenker. Bor, ifølge valensbindingsteorien (TEV), kan bare danne tre kovalente bindinger; i dette tilfellet tre B-O obligasjoner. Som en konsekvens av dette må den forventede geometrien være trigonal, BO3.
BO-molekylet3 det er elektronmangel, spesielt oksygenatomer; imidlertid flere av dem kan samhandle med hverandre for å levere nevnte mangel. Dermed trekantene BO3 bli sammen ved å dele en oksygenbro, og fordeles i rommet som nettverk av trekantede rader med planene orientert på forskjellige måter.
Krystallstruktur
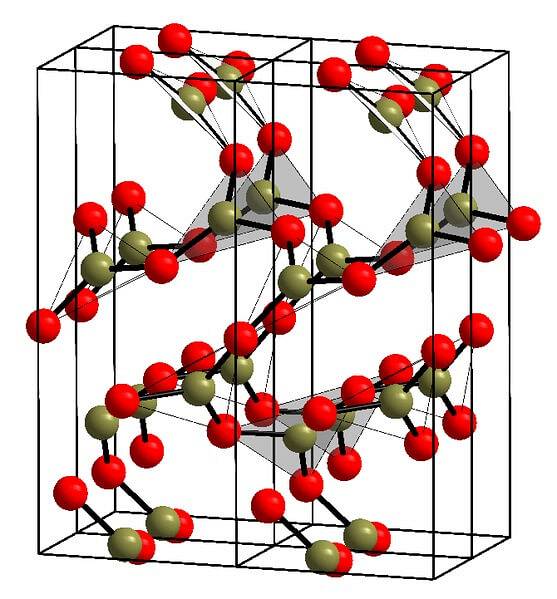
Et eksempel på slike rader med trekantede enheter BO er vist på bildet ovenfor.3. Hvis du ser nøye, peker ikke alle ansiktene til planene mot leseren, men den andre veien. Retningen til disse ansiktene kan være ansvarlig for hvordan B er definerttoELLER3 ved en viss temperatur og et bestemt trykk.
Når disse nettverkene har et langtrekkende strukturmønster, er det et krystallinsk fast stoff som kan bygges fra enhetscellen. Det er her det sies at BtoELLER3 har to krystallinske polymorfe: α og β.
Α-BtoELLER3 den produseres ved omgivelsestrykk (1 atm), og sies å være kinetisk ustabil; faktisk er dette en av grunnene til at boroksid sannsynligvis er en vanskelig å krystallisere forbindelse.
Den andre polymorfen, β-BtoELLER3, det oppnås ved høyt trykk i GPa-området; derfor må dens tetthet være større enn for α-BtoELLER3.
Glasslegemestruktur
BO-nettverk3 de har naturlig en tendens til å vedta amorfe strukturer; Disse mangler et mønster som beskriver molekylene eller ionene i det faste stoffet. Når du syntetiserer BtoELLER3 dens dominerende form er amorf og ikke krystallinsk; med rette ord: det er et fast stoff mer glassaktig enn krystallinsk.
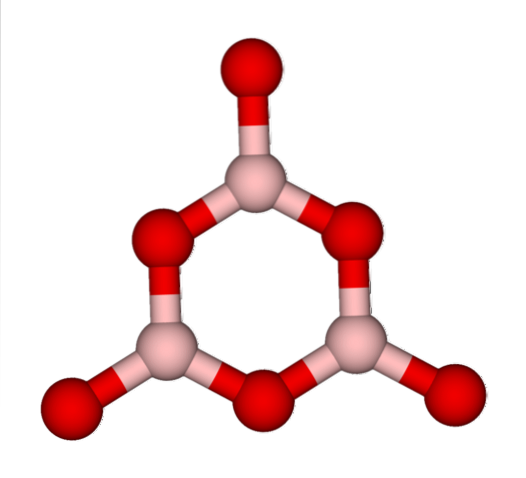
Det sies da at BtoELLER3 det er glassaktig eller amorft når dets BO-nettverk3 de er rotete. Ikke bare dette, men de endrer også måten de kommer sammen på. I stedet for å være ordnet i en trigonal geometri, ender de opp med å koble sammen for å skape det forskere kaller en boroksolring (toppbilde).
Legg merke til den åpenbare forskjellen mellom trekantede og sekskantede enheter. Trekanter preger BtoELLER3 krystallinsk og sekskantet til BtoELLER3 glasslegemet. En annen måte å referere til denne amorfe fasen er boreglass, eller med en formel: g-BtoELLER3 ('g' kommer fra ordet glassy, på engelsk).
Dermed g-B nettverktoELLER3 består av boroksolringer og ikke BO-enheter3. Imidlertid er g-BtoELLER3 kan krystallisere til α-BtoELLER3, som ville innebære en interkonvertering av ringer til trekanter, og vil også definere graden av oppnådd krystallisering.
Eiendommer
Fysisk utseende
Det er et fargeløst, glassaktig fast stoff. I sin krystallinske form er den hvit.
Molekylær masse
69,6182 g / mol.
Smak
Litt bitter
Tetthet
-Krystallinsk: 2,46 g / ml.
-Glasslegemet: 1,80 g / ml.
Smeltepunkt
Det har ikke et fullstendig definert smeltepunkt, fordi det avhenger av hvor krystallinsk eller glassaktig det er. Den rent krystallinske formen smelter ved 450 ° C; imidlertid smelter den glassete formen i et temperaturområde fra 300 til 700 ° C..
Kokepunkt
Igjen samsvarer ikke de rapporterte verdiene med denne verdien. Tilsynelatende koker flytende boroksyd (smeltet av krystaller eller glass) ved 1860 ºC.
Stabilitet
Det må holdes tørt, da det absorberer fuktighet for å transformere til borsyre, B (OH)3.
Nomenklatur
Boroksid kan navngis på andre måter, for eksempel:
-Diborontrioksid (systematisk nomenklatur).
-Bor (III) oksid (lagernomenklatur).
-Boroksid (tradisjonell nomenklatur).
applikasjoner
Noen av bruksområdene for boroksid er:
Syntese av bortrihalogenider
Fra BtoELLER3 kan syntetiseres bortrihalogenider, BX3 (X = F, Cl og Br). Disse forbindelsene er Lewis-syrer, og med dem er det mulig å innføre boratomer i visse molekyler for å oppnå andre derivater med nye egenskaper..
Insektmiddel
En fast blanding med borsyre, BtoELLER3-B (OH)3, representerer en formel som brukes som et husholdningsinsektmiddel.
Løsemiddel for metalloksider: dannelse av glass, keramikk og borlegeringer
Flytende boroksyd er i stand til å oppløse metalloksider. Fra denne resulterende blanding oppnås faste stoffer bestående av bor og metaller når de er avkjølt..
Avhengig av mengden BtoELLER3 brukt, så vel som teknikken, og typen metalloksyd, et rikt utvalg av glass (borosilikater), keramikk (bornitrider og karbider) og legeringer (hvis bare metaller brukes) kan oppnås.
Generelt får glass eller keramikk større motstand og styrke, og også større holdbarhet. Når det gjelder briller, blir de til slutt brukt til optiske linser og teleskoplinser og til elektroniske enheter..
Binder
Ved konstruksjon av smelteovner av stål brukes magnesiumbaserte ildfaste murstein. Boroksyd brukes som et bindemiddel, og hjelper til med å holde dem tett sammen..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Bortrioksid. Gjenopprettet fra: en.wikipedia.org
- PubChem. (2019). Boroksid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Borix oksid. 20 Mule Team Borax. Gjenopprettet fra: borax.com
- A. Mukhanov, O. O. Kurakevich og V. L. Solozhenko. (s.f.). På hardheten av bor (III) oksid. LPMTMCNRS, Université Paris Nord, Villetaneuse, Frankrike.
- Hansen T. (2015). BtoELLER3 (Boroksid). Gjenopprettet fra: digitalfire.com



Ingen har kommentert denne artikkelen ennå.