
Jodhistorie, egenskaper, struktur, oppnåelse, risiko, bruk
De jod Det er et reaktivt ikke-metallisk element som tilhører gruppe 17 i det periodiske systemet (halogener) og er representert med det kjemiske symbolet I. I hovedsak er det et ganske populært element, fra jodisert vann til hormonet tyrosin.
I fast tilstand er jod mørkegrått med en metallisk glans (nedre bilde) som er i stand til å sublimere for å produsere en fiolett damp som etterlater en mørk rest når den kondenseres på en kald overflate. Mange og attraktive har vært eksperimentene for å demonstrere disse egenskapene.

Dette elementet ble isolert for første gang av Bernard Curtois i år 1811, mens man oppnådde forbindelser som fungerte som råmateriale for produksjon av saltpeter. Imidlertid identifiserte Curtois ikke jod som et element, en fortjeneste delt av Joseph Gay-Lussac og Humphry Davy. Gay-Lussac identifiserte elementet som "iode", et begrep som kom fra det greske ordet "ioides" som fargen fiolett ble betegnet med..
Elementært jod, som de andre halogenene, er et diatomisk molekyl, som består av to jodatomer bundet av en kovalent binding. Van der Waals-interaksjonen mellom jodmolekyler er den sterkeste blant halogener. Dette forklarer hvorfor jod er halogenet med høyest smelte- og kokepunkt. I tillegg er det den minst reaktive av halogenene, og den med lavest elektronegativitet..
Jod er et viktig element som må inntas, siden det er nødvendig for kroppsvekst. hjerne og mental utvikling; metabolisme generelt, etc., anbefale et daglig inntak på 110 µg / dag.
Jodmangel i fostertilstanden til en person er forbundet med utseendet på kretinisme, en tilstand preget av bremsende kroppsvekst; samt utilstrekkelig mental og intellektuell utvikling, strabismus, etc..
I mellomtiden er en jodmangel i alle aldre hos individet forbundet med utseendet til en goiter, preget av hypertrofi i skjoldbruskkjertelen. Goiter er en endemisk sykdom, siden den er begrenset til visse geografiske områder med egne ernæringsegenskaper.
Artikkelindeks
- 1 Historie
- 1.1 Oppdagelse
- 1.2 Fremveksten av navnet
- 1.3 Historiske bruksområder
- 2 Fysiske og kjemiske egenskaper
- 2.1 Utseende
- 2.2 Standard atomvekt
- 2.3 Atomnummer (Z)
- 2.4 Smeltepunkt
- 2.5 Kokepunkt
- 2.6 Tetthet
- 2.7 Løselighet
- 2.8 Lukt
- 2.9 Fordelingskoeffisient for oktanol / vann
- 2.10 Nedbrytning
- 2.11 Viskositet
- 2.12 Trippelpunkt
- 2.13 Kritisk poeng
- 2.14 Fusjonsvarme
- 2.15 Fordampningsvarme
- 2.16 Molar varmekapasitet
- 2.17 Damptrykk
- 2.18 oksidasjonstall
- 2.19 Elektronegativitet
- 2.20 Ioniseringsenergi
- 2.21 Varmeledningsevne
- 2.22 Elektrisk motstand
- 2.23 Magnetisk rekkefølge
- 2.24 Reaktivitet
- 3 Struktur og elektronisk konfigurasjon
- 3.1 - Jodatom og dets bindinger
- 3.2 - Krystaller
- 3.3 - Faser
- 4 Hvor å finne og skaffe
- 4.1 Caliche
- 4.2 Saltlake
- 5 Biologisk rolle
- 5.1 - Anbefalt diett
- 5.2 - Skjoldbruskhormoner
- 5.3 - Mangel
- 6 Risiko
- 7 bruksområder
- 7.1 Leger
- 7.2 Reaksjoner og katalytisk virkning
- 7.3 Fotografering og optikk
- 7.4 Andre bruksområder
- 8 Referanser
Historie
Oppdagelse
Jod ble oppdaget av den franske kjemikeren Bernard Curtois, i år 1811, mens han jobbet med sin far i produksjonen av salpeter, og krevde natriumkarbonat for dette..
Denne forbindelsen ble isolert fra tang som de samlet utenfor kysten av Normandie og Bretagne. For å oppnå dette ble alger brent og asken ble vasket med vann, og ødela de resulterende restene med tilsetning av svovelsyre..
Ved en anledning, kanskje ved en tilfeldig feil, la Curtois til et overskudd av svovelsyre, og en purpur damp ble dannet som krystalliserte seg på de kalde overflatene og satte seg som mørke krystaller. Curtois mistenkte at han var i nærvær av et nytt element og kalte det "Substance X".
Curtois oppdaget at dette stoffet, når det ble blandet med ammoniakk, dannet et brunt fast stoff (nitrogentriiodid) som eksploderte ved den minste kontakt.
Imidlertid hadde Curtois begrensninger for å fortsette forskningen, og bestemte seg for å gi prøver av stoffet til Charles Desormes, Nicolas Clément, Joseph Gay-Lussac og André-Marie Ampère, for å oppnå deres samarbeid..
Fremveksten av navnet
I november 1813 gjorde Desormes og Clément Curtois oppdagelse offentlig. I desember samme år påpekte Gay-Lussac at det nye stoffet kunne være et nytt element, noe som antydet navnet "iode" fra det greske ordet "ioides", betegnet som fiolett..
Sir Humphry Davy, som mottok en del av prøven som ble gitt til Ampère av Curtois, eksperimenterte med prøven og bemerket en likhet med klor. I desember 1813 var Royal Society of London involvert i identifiseringen av et nytt element.
Selv om det oppstod en diskusjon mellom Gay-Lussac og Davy om identifikasjon av jod, erkjente de begge at Curtois var den første som isolerte det. I 1839 mottok Curtois endelig Montyn-prisen fra Royal Academy of Sciences i anerkjennelse av isoleringen av jod..
Historiske bruksområder
I 1839 ga Louis Daguerre jod sin første kommersielle bruk, og oppfant en metode for å produsere fotografiske bilder kalt daguerreotypier, på tynne metallplater..
I 1905 undersøkte den amerikanske patologen David Marine jodmangel i visse sykdommer og anbefalte inntaket.
Fysiske og kjemiske egenskaper
Utseende

Solid mørk grå med metallisk glans. Dampene er lilla i sublimering (toppbilde).
Standard atomvekt
126,904 u
Atomnummer (Z)
53
Smeltepunkt
113,7 ºC
Kokepunkt
184,3 ºC
Tetthet
Omgivelsestemperatur: 4,933 g / cm3
Løselighet
Den oppløses i vann for å produsere brune løsninger med en konsentrasjon på 0,03% ved 20 ºC..
Denne løseligheten økes betraktelig hvis det tidligere er oppløst jodidioner, siden en likevekt er etablert mellom I- og jegto å danne den anioniske arten I3-, som løser seg bedre enn jod.
I organiske løsningsmidler som kloroform, karbontetraklorid og karbondisulfid, oppløses jod og gir en lilla fargetone. På samme måte oppløses det i nitrogenholdige forbindelser, slik som pyridin, kinolin og ammoniakk, for å danne en brun løsning, igjen.
Forskjellen i fargene ligger i det faktum at jod er oppløst som solvatiserte molekyler Ito, eller som lasteoverføringskomplekser; sistnevnte vises når de er polare løsemidler (vann blant dem), som oppfører seg som Lewis-baser ved å donere elektroner til jod.
Lukt
Skarp, irriterende og karakteristisk. Luktterskel: 90 mg / m3 og irriterende luktterskel: 20 mg / m3.
Fordelingskoeffisient for oktanol / vann
Logg P = 2,49
Nedbrytning
Ved oppvarming til nedbrytning avgir den en røyk av hydrogenjodid og forskjellige jodidforbindelser..
Viskositet
2.27 cP ved 116 ºC
Trippel punkt
386,65 K og 121 kPa
Kritisk punkt
819 K og 11,7 MPa
Fusjonsvarme
15,52 kJ / mol
Fordampningsvarme
41,57 kJ / mol
Molar varmekapasitet
54,44 J / (mol K)
Damptrykk
Jod har et moderat damptrykk, og når beholderen åpnes sublimerer den sakte til en fiolett damp, irriterende for øynene, nesen og halsen..
Oksidasjonsnumre
Oksidasjonsnumrene for jod er: -1 (I-), +1 (I+), +3 (I3+), +4 (I4+), +5 (I5+), +6 (I6+) og +7 (I7+). I alle jodidsalter, som i tilfelle KI, har jod et oksidasjonsnummer på -1, siden vi i dem har anionet I-.
Jod får positive oksidasjonstall når det kombineres med mer elektronegative grunnstoffer enn det; for eksempel i dets oksider (ItoELLER5 og jeg4ELLER9) eller interhalogenerte forbindelser (I-F, I-Cl og I-Br).
Elektronegativitet
2,66 på Pauling-skalaen
Ioniseringsenergi
Først: 1.008,4 kJ / mol
Andre: 1845 kJ / mol
Tredje: 3.180 KJ / mol
Termisk ledningsevne
0,449 W / (m K)
Elektrisk motstand
1,39 107 Ω · m ved 0 ºC
Magnetisk rekkefølge
Diamagnetisk
Reaktivitet
Jod kombineres med de fleste metaller for å danne jodider, og også med ikke-metalliske elementer som fosfor og andre halogener. Jodidionet er et sterkt reduksjonsmiddel som spontant frigjør et elektron. Oksidasjon av jod gir en brunaktig fargetone av jod.
Jod, i motsetning til jodid, er et svakt oksidasjonsmiddel; svakere enn brom, klor og fluor.
Jod med oksidasjonsnummer +1 kan kombineres med andre halogener med oksidasjonsnummer -1 for å gi jodhalogenider; for eksempel: jodbromid, IBr. På samme måte kombineres det med hydrogen for å gi opphav til hydrogenjodid, som etter oppløsning i vann kalles hydrojodsyre..
Hydrojodsyre er en veldig sterk syre som er i stand til å danne jodider ved reaksjon med metaller eller deres oksider, hydroksider og karbonater. Jod har en +5 oksidasjonstilstand i jodsyre (HIO3), som er dehydrert for å produsere jodpentoksid (ItoELLER5).
Struktur og elektronisk konfigurasjon
- Jodatom og dets bindinger

Jod i grunntilstand består av et atom som har syv valenselektroner, bare ett fra å kunne fullføre sin oktett og bli isoelektronisk med edelgassen xenon. Disse syv elektronene er ordnet i 5- og 5p-orbitaler i henhold til deres elektroniske konfigurasjon:
[Kr] 4d10 5sto 5 s5
Derfor viser jeg atomer en sterk tendens til å binde kovalent slik at hver enkelt har åtte elektroner i sitt ytterste skall. Dermed nærmer seg to I-atomer og danner I-I-bindingen, som definerer det diatomiske molekylet Ito (toppbilde); molekylær enhet av jod i sine tre fysiske tilstander under normale forhold.
Bildet viser molekyl Ito representert av en romlig fyllingsmodell. Det er ikke bare et diatomisk molekyl, men også homonukleært og apolar; så deres intermolekylære interaksjoner (Ito - Jegto) styres av spredningsstyrkene i London, som er direkte proporsjonale med deres molekylære masse og størrelsen på atomene.
Denne I-I-bindingen er imidlertid svakere sammenlignet med de andre halogenene (F-F, Cl-Cl og Br-Br). Dette skyldes teoretisk den dårlige overlappingen mellom deres sp hybridorbitaler3.
- Krystaller
Molekylmassen til jegto lar dens spredningskrefter være retningsbestemte og sterke nok til å etablere en ortorombisk krystall ved omgivelsestrykk. Det høye elektroninnholdet får lyset til å fremme endeløse energioverganger, noe som fører til at jodkrystallene flekker svarte.
Imidlertid, når jod sublimerer, viser dampene en fiolett farge. Dette er allerede en indikasjon på en mer spesifikk overgang innenfor molekylære orbitaler til jegto (de med høyest energi eller anti-link).
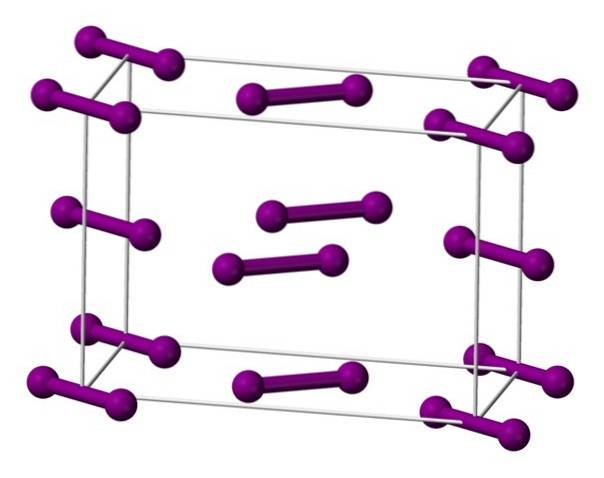
Molekyler I er vist ovenforto, representert av en modell av kuler og stenger, ordnet i den ortorhombiske enhetscellen.
Det kan sees at det er to lag: det nederste med fem molekyler, og det midterste med fire. Legg også merke til at et jodmolekyl sitter ved cellen. Glass er bygget ved periodisk å fordele disse lagene i alle tre dimensjoner..
Når man beveger seg i retning parallelt med I-I-bindingene, er det funnet at jodorbitalene overlapper for å generere et ledningsbånd, noe som gjør dette elementet til en halvleder; imidlertid forsvinner dens evne til å lede elektrisitet hvis retningen vinkelrett på lagene følges.
Koblingsavstander
Jeg-jeg-lenken ser ut til å ha utvidet seg; og faktisk er det, siden lengden på bindingen øker fra 266 pm (gassform), til 272 pm (solid state).
Dette kan skyldes at molekylene I i gassto de er veldig langt fra hverandre, deres intermolekylære krefter er nesten ubetydelige; mens de er i det faste stoffet, blir disse kreftene (I-I-I-I) håndgripelige, og tiltrekker jodatomene til to nabomolekyler mot hverandre og forkorter følgelig den intermolekylære avstanden (eller interatomisk, sett på en annen måte).
Så når jodkrystallet sublimerer seg, trekker I-I-bindingen seg sammen i gassfasen, siden nærliggende molekyler ikke lenger utøver den samme (dispersive) attraktive kraften på omgivelsene. Og også, logisk, avstanden jegto - Jegto øker.
- Faser
Det ble nevnt tidligere at I-I-obligasjonen er svakere sammenlignet med de andre halogenene. I gassfasen ved en temperatur på 575 ºC, 1% av molekylene Ito de bryter opp i individuelle I-atomer. Det er så mye varmeenergi at bare to jeg har kommet sammen igjen de skiller, og så videre.
Tilsvarende kan denne bindingsbrytingen oppstå hvis jodkrystallene påføres et enormt trykk. Ved å komprimere det for mye (under trykk hundretusenvis ganger høyere enn atmosfærisk), molekylene jegto blir omorganisert som en monatomisk fase I, og jod sies så å ha metalliske egenskaper.
Imidlertid er det andre krystallinske faser, for eksempel: kroppssentrert ortorhombisk (fase II), kroppssentrert tetragonal (fase III) og ansiktssentrert kubikk (fase IV).
Hvor å finne og skaffe
Jod har et vektforhold, i forhold til jordskorpen, på 0,46 ppm, og rangerer 61. i overflod i det. Jodmineraler er knappe, og jodforekomster som er kommersielt utnyttbare, er jodater..
Jodmineraler finnes i magmatiske bergarter med en konsentrasjon på 0,02 mg / kg til 1,2 mg / kg, og i magmatiske bergarter med en konsentrasjon på 0,02 mg til 1,9 mg / kg. Det finnes også i Kimmeridge-skifer, med en konsentrasjon på 17 mg / kg vekt.
Videre finnes jodmineraler i fosfatbergarter med en konsentrasjon fra 0,8 til 130 mg / kg. Sjøvann har en jodkonsentrasjon som varierer fra 0,1 til 18 µg / L. Tang, svamper og østers var tidligere de viktigste kildene til jod.
For tiden er imidlertid de viktigste kildene caliche, natriumnitratavleiringer i Atacama-ørkenen (Chile) og saltlake, hovedsakelig fra det japanske gassfeltet i Minami Kanto, øst for Tokyo, og gassfeltet Anadarko. Basseng i Oklahoma (USA).
Caliche
Jod ekstraheres fra caliche i form av jodat og behandles med natriumbisulfitt for å redusere det til jodid. Løsningen omsettes deretter med fersk ekstrahert jodat for å lette filtreringen. Caliche var den viktigste kilden til jod på 1800- og begynnelsen av 1900-tallet..
Saltlaken
Etter rensing behandles saltløsningen med svovelsyre, som produserer jodid..
Denne jodidløsningen reageres deretter med klor for å produsere en fortynnet jodoppløsning, som blir fordampet av en luftstrøm som blir avledet til et absorberende svoveldioksidstårn, noe som gir følgende reaksjon:
Jegto + 2 timertoO + SOto => 2 HI + HtoSW4
Deretter reagerer hydrogenjodidgassen med klor for å frigjøre jod i gassform:
2 HI + Clto => Jegto + 2 HC1
Og til slutt blir jod filtrert, renset og pakket for bruk..
Biologisk rolle
- Anbefalt kosthold
Jod er et viktig element, siden det griper inn i mange funksjoner i levende vesener, som er spesielt kjent hos mennesker. Den eneste måten jod kan komme inn i mennesker er gjennom maten han spiser.
Det anbefalte kostholdet for jod varierer med alderen. Dermed krever et barn på 6 måneder et inntak på 110 µg / dag; men fra fylte 14 år er det anbefalte dietten 150 µg / dag. I tillegg er det oppgitt at jodinntak ikke skal overstige 1100 µg / dag.
- Skjoldbruskhormoner
Skjoldbruskstimulerende hormon (TSH) skilles ut av hypofysen og stimulerer opptaket av jod av skjoldbruskkjertelen. Jod bæres inn i skjoldbruskkjertelen, kjent som kolloider, hvor det binder seg til aminosyren tyrosin for å danne monoiodotyrosin og diiodotyrosin..
I follikulært kolloid kombineres et molekyl av monoiodothyronine med et molekyl av diiodothyronine for å danne et molekyl som kalles triiodothyronine (T3). På den annen side kan to molekyler av diiodotyrosin bli sammen, og danne tetraiodothyronin (T4). T3 og T4 kalles skjoldbruskkjertelhormoner.
T-hormoner3 og T4 de skilles ut i plasma der de binder seg til plasmaproteiner; inkludert skjoldbruskhormontransportørprotein (TBG). De fleste av skjoldbruskkjertelhormonene transporteres i plasma som T4.
Imidlertid er den aktive formen for skjoldbruskhormoner T3, så T4 i de "hvite organene" i skjoldbruskkjertelhormonene gjennomgår den avjodering og forvandles til T3 å utøve sin hormonelle virkning.
Effekter rediger
Effektene av virkningen av skjoldbruskkjertelhormoner er flere, følgende er mulig å påpeke: økt metabolisme og proteinsyntese; fremme av kroppsvekst og hjerneutvikling; økt blodtrykk og hjertefrekvens, etc..
- Mangel
Mangel på jod og derfor av skjoldbruskkjertelhormonene, kjent som hypotyreose, har mange konsekvenser som påvirkes av personens alder.
Hvis jodmangel oppstår under en persons fosterstatus, er den mest relevante konsekvensen kretinisme. Denne tilstanden er preget av tegn som nedsatt mental funksjon, forsinket fysisk utvikling, strabismus og forsinket seksuell modning..
En jodmangel kan indusere en struma, uavhengig av alderen hvor mangelen oppstår. En struma er en overutvikling av skjoldbruskkjertelen, forårsaket av overdreven stimulering av kjertelen av hormonet TSH, frigjort fra hypofysen som et resultat av jodmangel..
Den overdrevne størrelsen på skjoldbruskkjertelen (struma) kan komprimere luftrøret og begrense luftens passasje gjennom den. I tillegg kan det forårsake skade på strupehalsnervene som kan føre til heshet..
Risiko
Forgiftning fra et overdreven inntak av jod kan forårsake forbrenning i munnen, halsen og feber. Også magesmerter, kvalme, oppkast, diaré, svak puls og koma.
Et overskudd av jod produserer noen av symptomene som er observert ved mangel: det er en hemming av syntesen av skjoldbruskhormoner, noe som øker frigjøringen av TSH, noe som resulterer i en hypertrofi av skjoldbruskkjertelen; dvs. en struma.
Det er studier som indikerer at overdreven inntak av jod kan forårsake tyreoiditt og papillær skjoldbruskkreft. I tillegg kan et overdreven inntak av jod interagere med medisiner, noe som begrenser deres virkning..
Overdreven inntak av jod i forbindelse med antityreoidemedisiner, som metimazol, brukt til å behandle hypertyreose, kan ha en additiv effekt og forårsake hypotyreose..
Angiotensin-converting enzym (ACE) -hemmere, som benazepril, brukes til å behandle hypertensjon. Inntak av for mye kaliumjodid øker risikoen for hyperkalemi og hypertensjon.
applikasjoner
Leger
Jod fungerer som et desinfeksjonsmiddel for huden eller såret. Den har nesten øyeblikkelig antimikrobiell virkning, trenger inn i det indre av mikroorganismer og samhandler med svovelaminosyrer, nukleotider og fettsyrer, noe som forårsaker celledød..
Den utøver sin antivirale virkning hovedsakelig på de dekkede virusene, og postulerer at den angriper proteinene på overflaten av de dekkede virusene..
Kaliumjodid i form av en konsentrert løsning brukes til behandling av tyrotoksikose. Det brukes også til å kontrollere effekten av stråling fra 131I ved å blokkere bindingen av den radioaktive isotopen til skjoldbruskkjertelen.
Jod brukes til behandling av dendrittisk keratitt. For å gjøre dette blir hornhinnen utsatt for vanndamp mettet med jod, og mister midlertidig epitel av hornhinnen; men det er full gjenoppretting fra det på to eller tre dager.
Også jod har gunstige effekter i behandlingen av cystisk fibrose i det menneskelige brystet. På samme måte har det blitt påpekt at 131Jeg kan være en valgfri behandling av skjoldbruskkjertelen.
Reaksjoner og katalytisk virkning
Jod brukes til å oppdage tilstedeværelsen av stivelse, noe som gir en blå fargetone. Reaksjonen av jod med stivelse brukes også til å oppdage tilstedeværelsen av falske sedler trykt på papir som inneholder stivelse..
Kalium (II) tetraiodomercurate, også kjent som Nesslers reagens, brukes til påvisning av ammoniakk. Likeledes brukes en alkalisk jodoppløsning i jodformtesten for å vise tilstedeværelsen av metylketoner..
Uorganiske jodider brukes til rensing av metaller, slik som titan, zirkonium, hafnium og thorium. I ett trinn av prosessen må tetraiodidene til disse metallene dannes.
Jod fungerer som en stabilisator for kolofonium, olje og andre treprodukter.
Jod brukes som katalysator i de organiske syntesereaksjonene av metylering, isomerisering og dehydrogenering. I mellomtiden brukes hydrojodsyre som en katalysator for produksjon av eddiksyre i Monsanto- og Cativa-prosessene..
Jod fungerer som en katalysator i kondensering og alkylering av aromatiske aminer, samt i sulfaterings- og sulfaneringsprosesser, og for produksjon av syntetiske gummier.
Foto og optikk
Sølvjodid er en viktig komponent i tradisjonell fotografisk film. Jod brukes til å produsere elektroniske instrumenter som enkeltkrystallprismer, polariserende optiske instrumenter og glass som kan overføre infrarøde stråler..
Andre bruksområder
Jod brukes til fremstilling av plantevernmidler, anilinfargestoffer og ftalin. I tillegg brukes den i syntesen av fargestoffer, og er et røykslukkingsmiddel. Og til slutt fungerer sølvjodidet som en kondenseringskjerne for vanndampen i skyene for å forårsake regn..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Stuart Ira Fox. (2003). Menneskelig fysiologi. Første utgave. Redigere. McGraw-Hill Interamericana
- Wikipedia. (2019). Jod. Gjenopprettet fra: en.wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi og Onoda Mitsuko. (2003). Modulert struktur av fast jod under dens molekylære dissosiasjon under høyt trykk. Naturvolum 423, sider 971-974. doi.org/10.1038/nature01724
- Chen L. et al. (1994). Strukturelle faseoverganger av jod ved høyt trykk. Institutt for fysikk, Academia Sinica, Beijing. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider & Karl Christe. (26. august 2019). Jod. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- Dr. Doug Stewart. (2019). Fakta om jodelementer. Chemicool. Gjenopprettet fra: chemicool.com
- Nasjonalt senter for bioteknologisk informasjon. (2019). Jod. PubChem-database. CID = 807. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Rohner, F., Zimmermann, M., Jooste, P., Pandav, C., Caldwell, K., Raghavan, R., & Raiten, D. J. (2014). Biomarkører av ernæring for utvikling av jod gjennomgang. The Journal of nutrition, 144 (8), 1322S-1342S. doi: 10.3945 / jn.113.181974
- Advameg. (2019). Jod. Kjemi forklart. Gjenopprettet fra: chemistryexplained.com
- Traci Pedersen. (19. april 2017). Fakta om jod. Gjenopprettet fra: livescience.com
- Megan Ware, RDN, LD. (30. mai 2017). Alt du trenger å vite om jod. Gjenopprettet fra: medicalnewstoday.com
- National Institute of Health. (9. juli 2019). Jod. Gjenopprettet fra: ods.od.nih.gov


Ingen har kommentert denne artikkelen ennå.