
Kaliumjodid (KI) struktur, egenskaper, oppnåelse, bruk, risiko

De kaliumjodid er en uorganisk forbindelse dannet av et kaliumion (K+) og et jodidion (I-). Den kjemiske formelen er KI. Det er et hvitt, krystallinsk fast stoff, ionisk og veldig løselig i vann..
KI gjør det mulig å utføre forskjellige kjemiske reaksjoner og analyser og brukes til å måle mengden ozon i atmosfæren. Brukes også i infrarødt (IR) analyseutstyr.

Kaliumjodid tilsettes vanlig bordsalt for å forhindre jodmangel hos mennesker, da dette kan være et alvorlig helseproblem..
Det brukes som slimløsende da det hjelper slim å strømme lett fra luftveiene til utsiden. Det brukes også til å behandle noen soppinfeksjoner og brukes i noe kosmetikk.
Det brukes av veterinærleger for å kurere dyr med problemer som ligner på mennesker, for eksempel hoste og hudinfeksjoner. Det tilsettes til og med i veldig små mengder dyrefôr.
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3,5 Tetthet
- 3.6 Løselighet
- 3,7 pH
- 3.8 Kjemiske egenskaper
- 3.9 Andre egenskaper
- 4 Motta
- 5 bruksområder
- 5.1 Ved behandling av hypertyreose
- 5.2 I andre medisinske applikasjoner
- 5.3 I veterinærapplikasjoner
- 5.4 Ved beskyttelse av skjoldbruskkjertelen i radioaktive nødsituasjoner
- 5.5 I målinger av ozon i atmosfæren
- 5.6 I forskjellige bruksområder
- 6 Risiko
- 7 Referanser
Struktur
Kaliumjodid er en ionisk forbindelse dannet av kaliumkation K+ og jodidanionet I-, derfor er bindingen ionisk mellom de to. Oksidasjonstilstanden for kalium er +1 og jodens valens er -1.
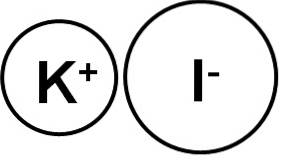
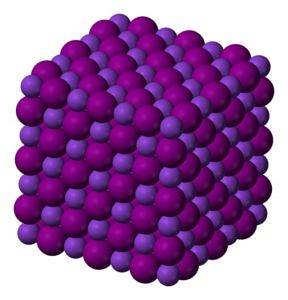
KI kaliumjodidkrystaller er kubiske.
Nomenklatur
- Kaliumjodid
- Kaliumjodid
Eiendommer
Fysisk tilstand
Fargeløst til hvitt krystallinsk fast stoff. Kubiske krystaller.
Molekylær vekt
166,003 g / mol
Smeltepunkt
681 ºC
Kokepunkt
1323 ºC
Tetthet
3,13 g / cm3
Løselighet
Svært løselig i vann: 149 g / 100 g vann ved 25 ° C. Litt løselig i etanol og eter.
pH
De vandige løsningene er nøytrale eller basiske, med en pH mellom 7 og 9.
Kjemiske egenskaper
Litt hygroskopisk i fuktig luft.
Den er stabil i tørr luft. Lys og fuktighet akselererer nedbrytningen, og fargen endres til gul på grunn av frigjøring av små mengder jod (Ito) og jodater (IO3-).
Vandige KI-løsninger blir også gule over tid, men litt alkali kan forhindre dette.
Disse løsningene oppløser jod (Ito) gir KI3:
Jeg- + Jegto → jeg3-
Andre egenskaper
Den har en sterk bitter og saltoppløsende smak. Det er ikke brannfarlig.
Å skaffe
Kaliumjodid kan oppnås ved oppvarming av jod (Itoi en konsentrert løsning av kaliumhydroksyd (KOH):
3 jegto + 6 KOH → 5 KI + KIO3 + HtoELLER
Den resulterende jodat- og jodidoppløsningen oppvarmes for å fjerne vann, reduseres til tørrhet, kull tilsettes og oppvarmes til høy temperatur. Kull tar oksygen fra jodat og oksyderer til karbondioksid og reduserer dermed jodat til jodid:
2 KIO3 + C → 2 KI + 3 COto
Det oppnådde kaliumjodidet kan omkrystalliseres for rensing. Det vil si at den løser seg opp igjen i vann og induseres til å krystallisere igjen..
applikasjoner
Ved behandling av hypertyreose
Kaliumjodid fungerer som en tilleggsbehandling sammen med andre antithyroid-midler for å behandle hypertyreose.
Hypertyreose er en sykdom som får skjoldbruskkjertelen til å produsere for mye skjoldbruskkjertelhormon, med forstørret skjoldbruskkjertel, reduksjon i vekt, rask hjerterytme og irritabilitet, blant andre symptomer..
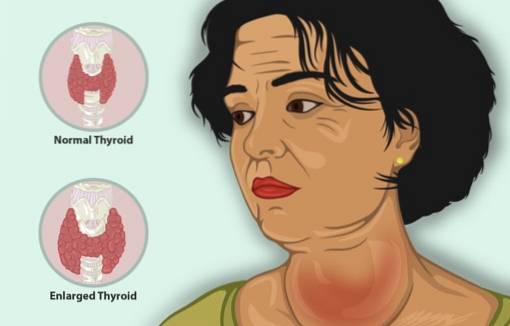
Hos pasienter med hypertyreose reduserer KI raskt symptomene da det hemmer frigjøringen av skjoldbruskkjertelhormon.
Virkningen på skjoldbruskkjertelen er: reduksjon i antall blodkar i kjertelen, oppstrammende vev og redusert størrelse på cellene.
Av denne grunn brukes den som en preoperativ behandling for å indusere involusjon eller reduksjon i skjoldbruskkjertelen før skjoldbruskkjertelektomi (fjerning av skjoldbruskkjertelen), da dette letter denne operasjonen..
I andre medisinske applikasjoner
Kaliumjodid har slimløsende egenskaper da det øker utskillelsen av luftveier, noe som resulterer i en reduksjon i slimviskositeten..

Det brukes til å behandle erytem nodosum, som er en smertefull hevelse i bena der det dannes røde knuter og en økning i temperaturen.
Det er et soppdrepende middel. Det tillater behandling av sporotrichose som er en hudinfeksjon forårsaket av en sopp. Denne sykdommen skjer med mennesker som jobber med planter og jord, som bønder og gartnere..
Det brukes også til behandling av jodmangel eller for å unngå det, og det blir derfor tilsatt bordsalt eller spiselig salt (natriumklorid NaCl) som en kilde til jod og noen ganger i drikkevann.
I veterinærapplikasjoner
Kaliumjodid administreres til dyr som et antitussive middel, for å øke og flytende væskene i luftveiene, for kronisk bronkial hoste, så vel som i tilfeller av revmatisme og som en betennelsesdempende.
Det brukes også til mykose (soppinfeksjoner) hos dyr, for å redusere kløe og for kronisk forgiftning med bly eller kvikksølv..
For å beskytte skjoldbruskkjertelen i radioaktive nødsituasjoner
Kaliumjodid har skjoldbruskbeskyttende egenskaper i tilfelle personen har blitt utsatt for kjernefysisk stråling.
KI oversvømmer skjoldbruskkjertelen med ikke-radioaktivt jod og blokkerer dermed opptaket av radioaktive molekyler og absorpsjonen av radioaktivt jod, og beskytter skjoldbruskkjertelen mot kreft som stråling kan forårsake..
I målinger av ozon i atmosfæren
Ozongass (O3) kan måles i atmosfæren ved hjelp av elektrolytiske celler kalt ozonesondes, som bæres av radiosonde ballonger.
Disse elektrolysecellene inneholder en KI-kaliumjodidoppløsning. Celler er i utgangspunktet i kjemisk og elektrisk likevekt.
Når en ozonluftprøve (O3) trenger inn i en av cellene, blir likevekten ødelagt fordi følgende reaksjon oppstår:
2 KI + O3 + HtoO → Jegto + ELLERto + 2 KOH
Denne reaksjonen produserer en elektrisk strøm som flyter mellom cellene..
Mengden produsert elektrisk strøm overføres kontinuerlig av radiobølger til en stasjon på bakken. På denne måten oppnås ozonprofilen fra bakken til kulens høyde..

I forskjellige bruksområder
Kaliumjodid tillater også:
- Eliminering av frie radikaler slik som hydroksylradikalen OH.
- Produksjon av fotografiske emulsjoner for å utfelle sølv.
- Forbedre dyrefôr ved å tilsette i mikromengder.
- Luktfjerne husdyrgjødsel.
- Overfør lyset fra det infrarøde spektrumet i IR-analyseutstyr.
- Utfør visse kjemiske reaksjoner og analyser i kjemilaboratorier.
- Bruk den i personlige hygieneprodukter.
- Utfør analyse av miljøforurensning.
Risiko
Noen mennesker som er følsomme for jodider, bør ta det med forsiktighet, da det kan forårsake jodisme eller kronisk jodforgiftning, for eksempel de med en autoimmun skjoldbruskkjertel..
Personer med tuberkulose eller akutt bronkitt bør også være forsiktige.
KI kan forårsake mykning av spyttkjertlene, det kan brenne munnen eller halsen, uvanlig økning i spytt, tannsmerter og betennelse i tannkjøttet og metallsmak, blant andre symptomer..
Det kan også irritere øynene og åpne sår på huden..
Referanser
- OSS. National Library of Medicine. (2019). Kaliumjodid. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Dean, J.A. (redaktør). (1973). Lange's Chemistry Handbook. Ellevte utgave. McGraw-Hill Book Company.
- Valkovic, V. (2019). Dekontaminering etter strålingseksponering. Mest følsomme kroppsdeler. In Radioactivity in the Environment (Andre utgave). Gjenopprettet fra sciencedirect.com.
- Smit, H.G.J. (2015). Chemistry of the Atmosphere-Observations for Chemistry (In Situ). I Encyclopedia of Atmospheric Sciences (andre utgave). Gjenopprettet fra sciencedirect.com.
- Muralikrishna, I.V. og Manickam, V. (2017). Analytiske metoder for overvåking av miljøforurensning. I miljøledelse. Gjenopprettet fra sciencedirect.com.
- Wallace, J.M. og Hobbs, P.V. (2006). Atmospheric Chemistry 1. In Atmospheric Science (Andre utgave). Gjenopprettet fra sciencedirect.com.



Ingen har kommentert denne artikkelen ennå.