
Aluminiumacetat (Al (CH3COO) 3) struktur, egenskaper, bruksområder

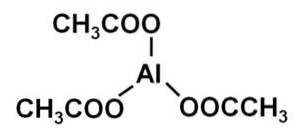
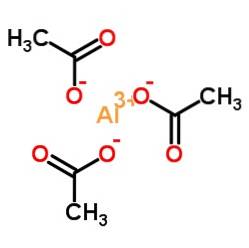
De aluminiumacetat er en organisk forbindelse dannet av et aluminiumion Al3+ og tre acetationer CH3COO-. Dens kjemiske formel er Al (CH3COO)3. Det er også kjent som aluminiumtriacetat. Det er et litt hygroskopisk hvitt fast stoff og løselig i vann..
For å oppnå denne forbindelsen må det brukes helt vannfrie forhold, det vil si fri for vann, ellers vil aluminiumdiacetatet Al (OH) (CH3COO)to.
Aluminiumacetatløsninger har antibakterielle og soppdrepende egenskaper, og det er derfor de siden 1800-tallet har blitt brukt til å behandle infeksjoner, spesielt i ørene..
Den mest kjente er Burows løsning, utviklet av en tysk lege. Imidlertid har bruken av og til ført til skade på mellomøret..
Denne løsningen har også blitt brukt til å behandle hudproblemer som kløe og utslett. Det brukes til og med som en solbrenthet.
Aluminiumacetat og dets derivater brukes til å oppnå svært små strukturer eller partikler av aluminiumoksyd AltoELLER3. Disse strukturene eller nanopartiklene kan være i form av blader, blomster eller nanorør..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Løselighet
- 3.4 Kjemiske egenskaper
- 3.5 Andre egenskaper
- 4 Motta
- 5 Bruk i medisin
- 5.1 Øreinfeksjoner
- 5.2 Hudsykdommer
- 6 Andre bruksområder
- 6.1 Utgått bruk
- 7 skadelige effekter
- 8 Referanser
Struktur
Aluminiumtriacetat består av et aluminiumskation Al3+ og tre acetatanioner CH3COO-. Det er aluminiumsaltet av eddiksyre CH3COOH.
Aluminium er bundet til acetatanioner gjennom oksygenet. Med andre ord er den festet til tre oksygener. Disse kryssene er ioniske.
Nomenklatur
- Aluminiumacetat
- Aluminium triacetat
- Aluminiumetanoat
- Burows løsning (oversettelse fra engelsk Burows løsning): Det er en løsning av aluminiumacetat.
Eiendommer
Fysisk tilstand
Solid hvit.
Molekylær vekt
204,11 g / mol
Løselighet
Løselig i vann.
Kjemiske egenskaper
I vandig løsning oppløses aluminiumtriacetat og har en tendens til å danne diacetat Al (OH) (CH3COO) og noen ganger Al (OH) monoacetatto(CH3COO). Alt avhenger av pH og mengden av eddiksyre CH3COOH til stede i løsningen.
Al (CH3COO)3 + HtoO ⇔ Al (OH) (CH3COO)to + CH3COOH
Al (CH3COO)3 + 2 timertoO ⇔ Al (OH)to(CH3COO) + 2 CH3COOH
Andre egenskaper
Aluminiumacetat er litt hygroskopisk, det vil si at det har en tendens til å absorbere vann fra luften.
Å skaffe
Aluminiumacetat oppnås fortrinnsvis under strengt vannfrie forhold, det vil si i totalt fravær av vann. Dette inkluderer også fravær av luft, da den kan inneholde fuktighet..
Varm opp en blanding av iseddik CH3COOH og eddiksyreanhydrid (CH3CO)toEller i forhold slik at alt tilstedeværende vann kan elimineres. Aluminiumklorid AlCl tilsettes til denne varme blandingen.3 vannfritt fast stoff (uten vann).
Et hvitt fast stoff av Al (CH3COO)3.
AlCl3 + 3 CH3COOH → Al (CH3COO)3 + 3 HC1
Det totale fraværet av vann er viktig for å unngå dannelse av salter av aluminiummonoacetat Al (OH)to(CH3COO) og aluminiumdiacetat Al (OH) (CH3COO)to.
Det kan også oppnås ved omsetning av aluminiumhydroksyd Al (OH)3 og eddiksyre CH3COOH.
Bruk i medisin
Øreinfeksjoner
Aluminiumacetat har blitt brukt siden 1800-tallet for å behandle otitt, som er en betennelse i ytre eller mellomøret som vanligvis ledsages av infeksjon. Bruken skyldes den antibakterielle og soppdrepende effekten.
Den har blitt brukt i form av en 13% aluminiumacetatoppløsning, opprinnelig utviklet av den tyske legen Karl August von Burow, og det er derfor den kalles Burows løsning..
Det har vist seg å hemme veksten av mikroorganismer som ofte finnes i otitis media eller externa, slik som otitis media. Pseudomonas aeruginosa, de Staphylococcus aureus og Proteus mirabilis.

Imidlertid er det de som rapporterer at disse løsningene kan være skadelige for øret. Noen dyreforsøk undersøker dets toksiske effekter på øret, men har rapportert motstridende resultater..
Enkelte forskere anbefaler at du ikke bruker aluminiumacetat når trommehinnen er perforert, da det har blitt observert å utøve en inflammatorisk effekt på mellomøret.
Hudsykdommer
Burows løsning brukes som en antiseptisk, snerpende og som en aktuell løsning for å behandle alvorlige utslett, dermatitt, betennelse, kløe, svie og solbrenthet. Har en beroligende og irritasjonsreduserende effekt.
Andre bruksområder
Aluminiumtriacetat og dets derivater brukes til mange kvalitative og kvantitative kjemiske eksperimenter.
Et derivat av aluminiumtriacetat, Al (OH) (CH3COO)to også kalt aluminiumhydroksydacetat, det brukes som en forløper for å oppnå nanostrukturer av gamma-aluminiumoksyd (γ-AltoELLER3).
I dette tilfellet betyr forløper at γ-Al-nanostrukturene fremstilles av aluminiumdiacetat (oppnådd på en bestemt måte).toELLER3, og dette oppnås ved å varme den opp til veldig høye temperaturer.
Nanostrukturer er veldig små partikler som bare kan observeres gjennom spesielle mikroskop som elektronmikroskop. Med aluminiumacetat som forløper er det oppnådd γ-Al-nanostrukturertoELLER3 ligner på blader, blomster, fibre og til og med nanorør.

Utgått bruk
På begynnelsen av 1900-tallet ble aluminiumacetat brukt som konserveringsmiddel i matvarer som hermetiske pølser.
En aluminiumacetatløsning ble fremstilt ved å blande aluminiumsulfat Alto(SW4)3, kalsiumkarbonat CaCO3, eddiksyre CH3COOH og vann HtoEller, og det ble lagt til maten.
Når denne løsningen kommer i kontakt med kjøttet, festes aluminiumet i bestanddelene i form av en forbindelse som er uoppløselig i kokende vann, men som oppløses i magesaft ca. 80%.
Allerede i 1904 var det kjent at aluminiumsalter reduserer fordøyelsen, både i magen og i tarmene. Derfor er det en uønsket praksis å tilsette aluminiumacetatløsninger i hermetikk..

Skadelige effekter
Siden det er studier som rapporterer at aluminiumacetat kan være giftig, har det blitt utført tester der laboratoriemus er injisert med aluminiumacetat.
Resultatene indikerer at denne forbindelsen forårsaker skade på ryggsøylen til nevnte dyr, så vel som skade på kromosomene og sædceller fra dyrene. Med andre ord er det genotoksisk.
Dette varsler deg om de potensielle helsefarene som kan være forårsaket av overeksponering for aluminiumacetat og om forsiktighet som bør utvises når du bruker det..
Referanser
- Mac-Kay Chace, E. (1904). Bruk av grunnleggende aluminiumacetat som konserveringsmiddel i pølse. Journal of the American Chemical Society 1904, 26, 6: 662-665. Gjenopprettet fra pubs.acs.org.
- Hood, G.C. og Ihde, A.J. (1950). Aluminiumacetater og propionater - deres fremstilling og sammensetning. Journal of the American Chemical Society 1950, 72, 5: 2094-2095. Gjenopprettet fra pubs.acs.org.
- Pitaro, J. et al. (2013). Ototoksisitet av aluminiumacetat / benzenetoniumklorid Otisk løsning i Chinchilla Animal Model. Laryngoskop, 2013; 123 (10): 2521-5. Gjenopprettet fra ncbi.nlm.nih.gov.
- Thorp, M.A. et al. (2000). Burows løsning i behandling av aktiv slimhinne kronisk suppurativ otitis media: bestemmelse av en effektiv fortynning. The Journal of Laryngology & Otology, juni 2000, bind 114, s. 432-436. Gjenopprettet fra ncbi.nlm.nih.gov.
- D'Souza, Mr. P. et al. (2014). Vurdering av gentoksisitet av aluminiumacetat i benmarg, kjønnsceller og føtale celler fra sveitsiske albinomus. Mutasjonsforskning 766 (2014) 16-22. Gjenopprettet fra ncbi.nlm.nih.gov.
- Basal, Y. et al. (2015). Effektene av aktuelle Burows og Castellanis løsninger på mellomørsmucosa av rotter. J. Int Adv Otol 2015; 11 (3): 253-6. Gjenopprettet fra advancedotology.org.
- OSS. National Library of Medicine. (2019). Aluminiumacetat. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Buttaravoli, P. og Leffler, S.M. (2012). Solbrenthet. Hva å gjøre. In Minor Emergencies (tredje utgave). Gjenopprettet fra sciencedirect.com.
- Thompson, E. og Kalus, A. (2017). Akutte hudreaksjoner og bakterielle infeksjoner. Behandling. I The Travel and Tropical Medicine Manual (Fifth Edition). Gjenopprettet fra sciencedirect.com.
- Kim, T. et al. (2010). Morfologi kontrollerbar syntese av gamma-aluminiumoksyd nanostrukturer via en ionisk væskeassistert hydrotermisk rute. Crystal Growth & Design, Vol. 10, nr. 7, 2010, s. 2928-2933. Gjenopprettet fra pubs.acs.org.
- Rajala, J.W. et al. (2015). Core-Shell Electrospun Hollow Aluminium Oxide Ceramic Fibers. Fibre 2015, 3, 450-462. Gjenopprettet fra mdpi.com.

Ingen har kommentert denne artikkelen ennå.