
Kaliumacetatstruktur, egenskaper, bruksområder, produksjon
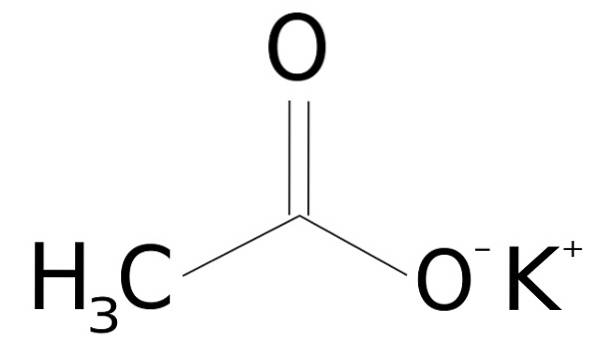
De kaliumacetat er en organisk forbindelse dannet av et kalium K-ion+ og et acetation CH3COO-. Den kjemiske formelen er CH3COOK, eller KCH3COO, eller også CtoH3KOto. Det er et fargeløst eller hvitt krystallinsk fast stoff, veldig løselig i vann..
Den brukes til å regulere surheten til visse industrielt bearbeidede matvarer. På grunn av sin store affinitet med vann, brukes den i laboratorier eller i visse prosesser for å absorbere vann fra andre forbindelser, for eksempel å dehydrere alkohol..

Kaliumacetat deltar i noen kjemiske reaksjoner som en akselerator for disse og i syntesen av organiske forbindelser. Det gjør det også mulig å øke dannelsen av antistoffer (naturlige stoffer som bekjemper infeksjoner) i industrielle metoder for å produsere dem..
Dens meget lave temperaturegenskaper gjør den til en god kandidat for bruk i issmeltende blandinger på betongveier i veldig kaldt klima. I følge konsulterte kilder brukes den også i brannslokkingsutstyr og i samlinger for å observere celler i mikroskop..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Tetthet
- 3.5 Løselighet
- 3,6 pH
- 3.7 Andre egenskaper
- 3.8 Oppførsel ved oppvarming
- 4 Motta
- 5 bruksområder
- 5.1 I forskjellige applikasjoner
- 5.2 I polymerindustrien
- 5.3 I vitenskapelige og medisinske forskningslaboratorier
- 5.4 I industriell produksjon av antistoffer
- 5.5 I frostvæskeblandinger
- 5.6 Hvordan det fungerer som frostvæske
- 6 Referanser
Struktur
Kaliumacetat består av et kalium K-kation+ og et acetatanion CH3COO-. Sistnevnte er den konjugerte basen av eddiksyre CH3COOH. Acetationen CH3COO- består av en metyl -CH3 festet til et karboksylat -COO-.
Forbindelsen mellom begge ioner er elektrostatisk eller ionisk, det vil si foreningen mellom et positivt og et negativt ion.
Nomenklatur
- Kaliumacetat
- Kaliumetanoat
- Kaliumsalt av eddiksyre
- AcOK
- KOAc
Eiendommer
Fysisk tilstand
Fargeløst eller hvitt krystallinsk fast stoff.
Molekylær vekt
98,14 g / mol
Smeltepunkt
292 ºC
Tetthet
1,6 g / cm3
Løselighet
Svært løselig i vann: 256 g / 100 ml ved 20 ° C.
pH
En 5% vandig løsning av kaliumacetat har en pH på 7,5-9,0.
Andre egenskaper
Noen ganger har den en svak eddikslukt. I 10% løsning angriper den ikke aluminium ved romtemperatur, men ved 60-70 ° C blir metallet mørkere og lider av grop.
Ved konsentrasjoner på 20% eller mer skjer overflateangrep på aluminium ved hvilken som helst temperatur.
Kaliumacetat (AcOK) er svært løselig i vann. Den har et hydrat: KCH3COO.1,5HtoEller som er det faste stoffet som oppnås ved å krystallisere det fra de vandige løsningene av AcOK.
Atferd ved oppvarming
Hvis det hydratiserte kaliumacetatet (AcOK) (KCH3COO.1,5HtoO) når den når 40 ° C, begynner den å miste hydratiseringsvannet.
KCH3COO.1,5HtoO → KCH3COO + 1,5HtoEller ↑
Hvis vannfri kaliumacetat varmes opp (uten vann: KCH3COO), når den når 340 ° C, begynner den å spaltes og danner kaliumkarbonat KtoCO3 i henhold til følgende reaksjon:
2 KCH3COO + 4 Oto → KtoCO3 + 3 HtoO + 3 COto↑
Å skaffe
Det kan fremstilles ved innvirkning av kaliumhydroksyd KOH på forskjellige forbindelser, slik som eddiksyre CH3COOH, eddiksyreanhydrid (CH3CO)toO og ammoniumacetat CH3COONH4.
KOH + CH3COOH → CH3COOK + HtoELLER
Det kan også oppnås ved å reagere kaliumkarbonat KtoCO3 eller KHCO kaliumbikarbonat3 med eddiksyre CH3COOH.
KHCO3 + CH3COOH → CH3COOK + HtoO + COto↑
Kaliumacetat kan krystalliseres fra vandig oppløsning for å oppnå høy renhet.
applikasjoner
I forskjellige applikasjoner
Kaliumacetat brukes i prosessindustrien som en surhetsregulator. Det brukes som tørkemiddel i kjemiske metoder for å måle vanndamppermeabiliteten til noen stoffer..
Den tjener som et dehydratiseringsmiddel for etanol i produksjonen av denne alkoholen med utgangspunkt i lignocellulose, et materiale avledet fra tre..
Den brukes til å produsere antibiotika og brukes mye i brannslokkingsutstyr.
I polymerindustrien
Det brukes til å resirkulere polyuretaner, da det tjener til å katalysere eller akselerere hydrolyse- og glykolysereaksjonene til nevnte polymerer slik at de blir alkoholer og aminer..
Det brukes også i produksjonen av organiske silikonharpikser.
I vitenskapelige og medisinske forskningslaboratorier
Kaliumacetat med høy renhet brukes i laboratorier som et reagens i analytisk kjemi. Også for å utføre medisinsk-vitenskapelig forskning.
I histopatologilaboratorier brukes den til å sikre et nøytralt pH-medium i mikroskopoppsett..

Den brukes til syntese av heterosykliske organiske forbindelser, som er forbindelser med forskjellige størrelsessykluser..
Enkelte mikroelektroder som brukes til å studere de elektriske egenskapene til celler, er fylt med en konsentrert løsning av kaliumacetat..
I den industrielle produksjonen av antistoffer
Kaliumacetat brukes til storproduksjon av monoklonale antistoffer (som er de som kommer fra samme stamcelle) i cellekulturer. Lar stimulere syntesen eller dannelsen av antistoffer.
Antistoffer er stoffer som produseres av noen celler i blodet for å bekjempe infeksjoner fra virus eller bakterier..

I frostvæskeblandinger
Kaliumacetat har blitt brukt i frostvæskeblandinger. ising) for å bruke dem til å smelte is på veier og sementbelegg og dermed tillate sikker bruk av disse.

Valget av kaliumacetat (AcOK) for denne applikasjonen skyldes det faktum at en 50 vekt% vandig løsning av AcOK er eutektisk og har et smeltepunkt på -62 ° C. Dette betyr at løsningen forblir smeltet selv ved temperaturer så lave som -62 ° C..
En eutektikum er en homogen blanding av komponenter som har det laveste smeltepunkt av alle mulige blandinger av disse, inkludert de rene komponentene..
Hvordan det fungerer som frostvæske
Kaliumacetat (AcOK) har en meget god evne til å smelte is.
Ved -5 ° C er den i stand til å smelte 11,5 kg is for hvert kg AcOK. Denne egenskapen synker når temperaturen synker, men selv ved -50 ° C har den evnen til å smelte 1,3 kg is for hvert kg AcOH..
Ved -5 ° C er denne kapasiteten sammenlignbar med den for natriumklorid eller bordsalt (NaCl), mens den fra -30 ° C langt overstiger den.

Imidlertid ble det i testene utført med AcOK sammen med andre forbindelser observert en viss grad av korrosjon av sementoverflatene, så det ble vurdert å tilsette korrosjonshemmende midler til frostvæskeblandingene..
På den annen side er blandingen av kaliumacetat (CH3COOK) med kaliumformiat (HCOOK) er et utmerket frostvæske og krever ikke korroderende.
Referanser
- Baker, F.J. et al. (1976). Fargeprosedyrer. Vandige bergarter. I introduksjon til medisinsk laboratorieteknologi (femte utgave). Gjenopprettet fra sciencedirect.com.
- Hassan, A.A. et al. (2018). Indazoler: Syntese og bindingsdannende heterosyklisering. Fremskritt innen heterosyklisk kjemi. Gjenopprettet fra sciencedirect.com.
- OSS. National Library of Medicine. (2019). Kaliumacetat. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Das, A. og Alagirusamy, R. (2010). Fuktoverføring. Tørremiddel omvendt koppmetode. I vitenskap i kleskomfort. Gjenopprettet fra sciencedirect.com.
- Vargel, C. (2004). Karboksilsyrer og deres derivater. Acetater. I korrosjon av aluminium. Gjenopprettet fra sciencedirect.com.
- Cuevas, J. (2014). Elektrofysiologiske opptaksteknikker. Intracellular opptaksteknikker. I referansemodul i biomedisinsk vitenskap. Gjenopprettet fra sciencedirect.com.
- Fink, J.K. (2018). Poly (uretan) s. Gjenvinning. Solvolyse. I Reactive Polymers: Fundamentals and Applications (Tredje utgave). Gjenopprettet fra sciencedirect.com.
- Fong, W. et al. (1997). Optimalisering av monoklonalt antistoffproduksjon: kombinerte effekter av kaliumacetat og perfusjon i en omrørt tankbioreaktor. Cytoteknologi 24: 47-54. Gjenopprettet fra link.springer.com.
- Danilov, V.P. et al. (2012). Anti-ising reagenser ved lave temperaturer i vandige saltsystemer som inneholder acetater og formiater. Theoretical Foundations of Chemical Engineering, 2012, Vol 46, No. 5, pp. 528-535. Gjenopprettet fra link.springer.com.
- Fakeev, A.A. et al. (2012). Forskning og utvikling av metode for kaliumacetat med høy renhet. Journal of Applied Chemistry, 2012, Vol. 85, No.12, pp. 1807-1813. Gjenopprettet fra link.springer.com.



Ingen har kommentert denne artikkelen ennå.