
Acinetobacter baumannii egenskaper, morfologi, symptomer
Acinetobacter baumannii Det er en gramnegativ bakterie som tilhører rekkefølgen av Pseudomonas. Gjennom sin taksonomiske historie har den blitt lokalisert i slektene Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea Y Achromobacter, til den ble plassert i sin nåværende sjanger i 1968.
TIL. baumannii det er en patogen bakterie, regnes som arten som ofte er involvert i infeksjoner i slekten. Det har blitt identifisert som involvert i forskjellige typer infeksjoner som septikemi, lungebetennelse og hjernehinnebetennelse.
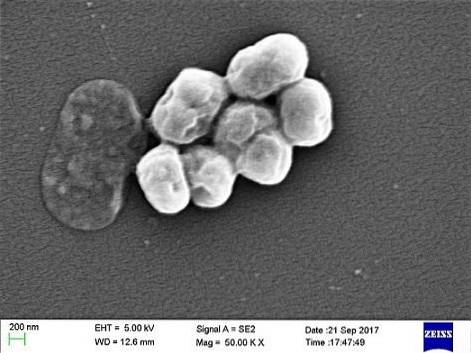
Det er en opportunistisk parasitt som har en betydelig forekomst i sykehus- eller nosokomiale sykdommer. Overføring ved mekanisk ventilasjon har blitt identifisert som en viktig årsak til smitte, spesielt i intensivavdelinger.
Til tross for å være ansett som et patogen av lav grad, har det evnen til å øke virulensen i stammer involvert i hyppige infeksjoner. Den har stor kapasitet til å utvikle resistens og multiresistens mot antibiotika.
På sykehus overføres det hovedsakelig ved kontakt med personalet, ved bruk av forurenset sykehusmateriale og også gjennom luften over korte avstander.
Verdens helseorganisasjon inkluderer A. baumannii på en liste over resistente patogener som det er presserende behov for nye antibiotika, og tildeler den kategori 1, med kritisk prioritet.
Artikkelindeks
- 1 Kjennetegn ved Acinetobacter baumannii
- 2 Morfologi
- 3 Metabolisme
- 4 Motstand mot antibiotika
- 5 patologier
- 6 symptomer
- 7 Behandling
- 8 Referanser
Kjennetegn ved Acinetobacter baumannii
Alle arter av slekten Acinetobacter har en bred fordeling i forskjellige naturlige nisjer. A. baumannii det kan naturlig bo i huden til friske mennesker, og være i stand til å kolonisere slimhinneoverflater, som utgjør et viktig epidemiologisk reservoar. Imidlertid levestedet til A. baumannii er nesten eksklusivt for sykehusinnstillinger.
Disse bakteriene mangler flageller eller strukturer som brukes til bevegelse. Imidlertid oppnår de bevegelse gjennom strukturer som tillater dem å utvide og trekke seg tilbake, og gjennom kjemiske mekanismer som utskillelse av en film med et høymolekylært eksopolysakkarid bak bakteriene..
A. baumannii kan kolonisere et stort antall levende eller inerte miljøer og har stor evne til å overleve på kunstige overflater over lengre tid.
Denne evnen skyldes muligens deres evne til å motstå dehydrering, å bruke forskjellige karbonkilder gjennom forskjellige metabolske veier, og på grunn av evnen til å danne biofilmer. Av denne grunn er det vanlig å finne det i sykehusmateriale, som katetre og mekaniske ventilasjonsanordninger..
Morfologi
A. baumannii er en coccobacillus, med en mellomform mellom kokker og stenger. De måler 1,5 til 2,5 med 1 til 1,5 mikron når populasjoner er i en logaritmisk vekstfase. De er mer sfæriske når de når den stasjonære fasen.
Metabolisme
Bakteriene A. baumannii det er ikke en glukose fermenter; det er strengt aerobt, det vil si at det krever oksygen for stoffskiftet.
Arten av slekten Acinetobacter de er de eneste i Moraxellaceae-familien som mangler cytokrom c oksidaser, som de gir negative resultater for i oksidasetester.
A. baumannii vokser ved temperaturer som varierer mellom 20 og 44 ° C, og er den optimale temperaturen mellom 30 og 35 ° C.
Antibiotikaresistens
Den konstante genereringen av resistens mot antibiotika hindrer ikke bare behandling og kontroll av infeksjoner forårsaket av A. baumannii, det fremmer også valg av endemiske og epidemiske multiresistente stammer.
Noen iboende mekanismer for A. baumannii, som fremmer antibiotikaresistens:
- Nærværet av β-laktamaser gir motstand mot b-laktamer.
- Produksjonen av spesifikke enzymer som ammoniglukosid-3'-fosfotransferase VI inaktiverer amikacin.
- Tilstedeværelsen av oksacillinase OXA-51 hydrolyserer penicilliner og karbapenemer.
- Tilstedeværelsen og overekspresjonen av tilbakeløpspumper, som er pumper som driver små molekyler ut av cellen som klarer å trenge gjennom cytoplasmaet, og dermed reduserer deres følsomhet for antibiotika.
Biofilmene generert av A. baumannii endre metabolismen til mikroorganismer, redusere følsomheten for antibiotika, i tillegg til å gi en fysisk barriere mot store molekyler og forhindre dehydrering av bakterier.
Patologier
A. baumannii koloniserer en ny vert ved kontakt med smittede mennesker, eller med forurenset medisinsk utstyr. Først og fremst fester denne bakterien seg på huden og slimhinneoverflatene. For å reprodusere, må den overleve antibiotika og hemmere og forholdene til disse overflatene..
Økningen i antall bakterier på slimhinneoverflater, spesielt under sykehusinnleggelser i kontakt med intravaskulære katetre eller endotrakeale rør, kan øke risikoen for infeksjon i luftveiene og blodet..
Sykehusoppkjøpt lungebetennelse er den vanligste av infeksjonene forårsaket av A. baumanii. Vanligvis kontrakt i Intensive Care Units, av pasienter som får mekanisk assistert respirasjon.
A. baumanii det har også forårsaket store infeksjonsproblemer hos militært personell med traumer etter krigen, spesielt i Irak og Afghanistan. Spesielt på grunn av osteomyelitt og bløtvevsinfeksjoner, som kan forårsake nekrose og cellulitt.
Det er også risiko for hjernehinnebetennelse fra A. baumanii hos pasienter som kommer seg etter nevrokirurgi.
Personer som er utsatt for infeksjoner av A. baumanii inkluderer de som tidligere har blitt utsatt for bruk av antibiotika, større operasjoner, brannsår, traumer, immunsuppresjon eller bruk av invasive medisinsk utstyr, hovedsakelig mekanisk ventilasjon, i intensivavdelinger.
Symptomer
Det er ingen spesifikk symptom på infeksjoner av A. baumanii. Hver av de forskjellige infeksjonene som produseres av denne bakterien har sine egne karakteristiske symptomer..
Generelt symptomene på infeksjoner som kan innebære A. baumanii eller andre opportunistiske bakterier som Klebsiella pneumoniae Y Streptococcus pneumoniae, kan omfatte feber, frysninger, utslett, smertefull vannlating, presserende behov for å tisse ofte, forvirring eller endrede mentale tilstander, kvalme, muskelsmerter, brystsmerter og hoste.
Behandling
Antibiotika for å behandle infeksjoner ved A. baumannii de er ekstremt begrensede på grunn av deres store evne til å skaffe motstander og multimotstander. Av denne grunn er det viktig å bestemme følsomheten for hver stamme for forskjellige antibiotika for å garantere effektiviteten av hver behandling..
Gitt motstanden mot karbapenemer, har det blitt brukt til bruk av polymyxiner, spesielt colistin, til tross for at de har en relativt lav resistensindeks og dens bivirkninger på nyrene..
Imidlertid har colistinresistente stammer allerede blitt oppdaget. Som et alternativ til resistens mot disse antibiotika, har kombinasjonsbehandling blitt brukt.
Referanser
- Bergogne-Bérézin, E. & Towner, K.J. Acinetobacter spp. som nosokomiale patogener: mikrobiologiske, kliniske og epidemiologiske trekk. Clin Microbiol Rev, 9 (1996), s. 148-165.
- Fournier, P.E., Richet, H. (2006). Epidemiologi og kontroll av Acinetobacter baumanii i helsevesenet. Kliniske smittsomme sykdommer, 42: 692-9.
- Hernández Torres, A., García Vázquez, E., Yagüe, G. &, Gómez Gómez, J. (2010) Acinetobacter baumanii Multiresistent: nåværende klinisk situasjon og nye perspektiver Revista Española de Quimioterapia, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: Epidemiologi, antimikrobiell resistens og behandlingsalternativer. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.j., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: infeksjoner hos mennesker, faktorer som bidrar til patogenese og dyremodeller. FEMS Microbiology Reviews, 37: 130-155.
- Peleg, A.Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: fremveksten av et vellykket patogen. Kliniske mikrobiologiske anmeldelser, 21 (3): 538-82.
- Vanegas-Múnera, J.M., Roncancio-Villamil, G. & Jiménez-Quiceno, J.N. (2014). Acinetobacter baumannii: klinisk betydning, motstandsmekanismer og diagnose. CES Medicine Magazine, 28 (2): 233-246.


Ingen har kommentert denne artikkelen ennå.