
Adiponectin struktur, funksjon, reseptorer, virkningsmekanisme
De adiponektin det er et av de mest utbredte sekretoriske proteinene produsert av en spesiell type celler kjent som adipocytter, karakteristisk for fettvev. Det er ansvarlig for å øke sensitiviteten for insulin og er involvert i energi homeostase og fedme.
Det humane adiponektingenet ble klonet fra fettvev i 1996, under eksperimenter av Matsuzawa, som kalte det det mest utbredte fettgen transkript-1 (apM1). fettrikeste gentranskript 1).
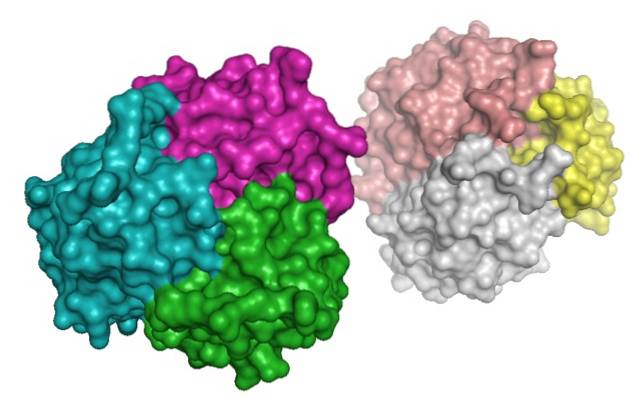
Proteinet ble derimot identifisert i blodplasma samme år av Nakano et al..
Dette hormonet bidrar til integrering av endokrine og metabolske signaler som er relatert til kontroll av energihomeostase. Dets uttrykk induseres under adipocyttdifferensiering og sirkulerer i serum ved relativt høye konsentrasjoner..
Artikkelindeks
- 1 Struktur
- 2 Funksjon
- 3 mottakere
- 3.1 T-kadherin
- 4 Handlingsmekanisme
- 5 Normale verdier
- 6 Referanser
Struktur
Adiponectin tilhører komplement 1q (C1q) -familien og kan finnes i blodplasma i et bredt utvalg av multimere komplekser (av flere underenheter): trimere, heksamerer og multimerer med høy molekylvekt (på mer enn 18 underenheter).
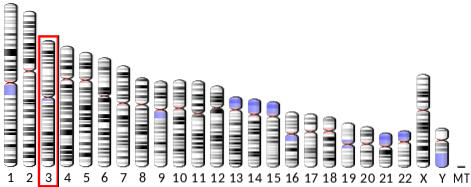
Genet som koder for adiponektin (ADIPOQ) ligger på den lange armen av kromosom 3 hos mennesker, har 16 kilo baser og har 3 eksoner. Dets uttrykk gir et vannløselig protein, sammensatt av 247 aminosyrerester og en molekylvekt på litt under 30 kDa, med et isoelektrisk punkt på 5,42.
Den består av fire domener: en signalsekvens ved den N-terminale enden, en variabel region, et kollagen-domene (cAd) og et globalt C-terminal domene..
I den aminoterminale delen skilles det ut en kollagenlignende sekvens kjent som kollagendomenet, som er en region med stor betydning for dannelsen av multimerer og er sterkt konservert mellom arter..
Hydroksylering og samtidig glykosylering av lysinrester i kollagendomenet til dette proteinet er det som muliggjør dannelse av trimerer, som samtidig kan assosieres med hverandre for å danne heksamerer og andre komplekser med høy molekylvekt..
Disse kompleksene har tilsynelatende "mål" vevsspesifisitet, for eksempel er komplekser med høy molekylvekt mer aktive i leveren, mens trimere og heksamerer virker uten mye forskjell i et stort utvalg av vev..
Kuleområdet ved C-terminalen, kalt globulært domene eller gAd, er homologt med proteiner slik som kollagen VIII og kollagen X, samt komplementfaktor C1q..
Funksjon
Generelt sett antas det at hormonet adiponectin virker på en relevant måte i reguleringen av metabolismen av lipider og karbohydrater i forskjellige insulinfølsomme vev..
Dette virker på forskjellige kroppsvev, siden reseptorene uttrykkes flere steder. Adiponectin, produsert utelukkende av adipocytter, fremmer biosyntese av fettsyrer og inhibering av glukoneogenese i leveren, et av vevene der AdipoR2-reseptoren finnes..
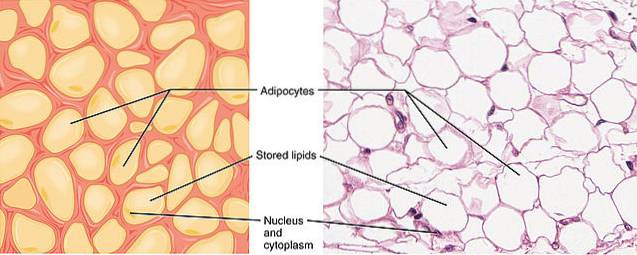
I skjelettmuskulatur, der AdipoR1- og AdipoR2-reseptorene finnes, fremmer det oksidasjon av fettsyrer og innføring av glukose i muskelcellene.
Adiponectin forbedrer også insulinresistens hos noen pasienter, siden det reduserer mengden intracellulært fett ved å aktivere oksidasjon av fettsyrer i både muskler og lever..
Enkelte forfattere antyder at dette hormonet også fungerer som en antioksidant, som et antiinflammatorisk middel og som en anti-arteriosklerotisk faktor.
Mottakere
De forskjellige adiponektinkompleksene ser ut til å ha noen preferanse fremfor spesifikt vev. Disse vevsspesifikke interaksjonene oppstår som respons på differensialuttrykket av forskjellige typer adiponektinreseptorer..
Adiponectin-reseptorer (AdipoR) er G-proteinkoblede reseptorer som tilhører familien av reseptorer kjent som PAQR. To typer er kjent: AdipoR1 og AdipoR2. Begge opprettholder sine N-terminale domener i det intracellulære rommet, mens deres C-terminale domener utsettes for det ekstracellulære rommet..
Reseptorer av AdipoR1-typen har 375 aminosyrer og molekylvekt på 42 kDa, mens reseptorer av AdipoR2-typen har 311 aminosyrer og en vekt på 35 kDa. Begge har 7 transmembrane domener, det vil si at strukturen deres krysser plasmamembranen til cellene der de blir funnet 7 ganger..
Det er omtrent 70% sekvenshomologi mellom begge reseptorer, med unntak av deres N-terminale ender, som er spesifikke for hver enkelt..
Både AdipoR1 og AdipoR2 uttrykkes i alle vev, selv om deres overflod varierer fra den ene til den andre. AdipoR1 er primært i skjelettmuskulatur og AdipoR2 er i både skjelettmuskulatur og lever.
T-cadherin
Det er også en "antatt" reseptor for adiponektin kjent som T-cadherin, som består av et enkelt kadherinmolekyl som har mistet sine cytosoliske og transmembrane domener, og er bundet til celleoverflaten gjennom glykosylfosfatidylinositolankre (GPI-ankre).
Denne adiponectin “reseptoren” uttrykkes i alle vev, men det er rapportert med større overflod i hjertet, i aorta, halspulsårene og iliacarteriene og i nyrearteriene..
Virkningsmekanismen
Selv om mekanismer for adiponektinproduksjon og frigjøring i blodet ikke er fullstendig forstått, antas det at signaloverføringsveien begynner med adiponectinbinding til membranreseptorer på målcellene..
Dette hormonet induserer aktivering av AMP-aktivert proteinkinase (AMPK), som skjer gjennom et "adapter" -protein som inneholder et domene av homologi til pleckstrin (typisk for proteiner involvert i cellesignaliseringsprosesser) og et domene av fosfotyrosinbinding (PTB) , pluss et leucin-lukkemotiv 1 (APPL).
APPL-domenet er det som binder seg til den intracellulære delen av en av de to AdipoR-reseptorene. Et lite GTPase-protein, kjent som Rab5, binder seg til et av stedene i det leucin-lukkende domenet og fremmer membrantranslokasjon av GLUT4, en insulinregulert glukostransportør..
I tillegg virker adiponectin på en kjernefysisk transkripsjonsfaktor kjent som PPARα, som er viktig med tanke på protein-, lipid- og karbohydratmetabolisme, samt celledifferensiering og utvikling..
Normale verdier
De normale rapporterte verdiene for adiponectin i blodplasma tilsvarer multimere komplekser av dette proteinet, hvis konsentrasjonsområde er mellom 5 og 20 mikrogram per milliliter, selv om konsentrasjoner på opptil 30 mikrogram per milliliter også er dokumentert..
Tatt i betraktning det ovennevnte, er det verdt å nevne at konsentrasjonen av adiponektin i plasma varierer betydelig; kvinner, for eksempel, har en tendens til å ha høyere verdier enn menn.
Verdiene til dette hormonet avhenger sterkt av ernæringsstatus, tilstedeværelse eller fravær av patologi osv., Men er generelt omvendt korrelert med fett og med tilstander som hjerte- og karsykdommer, hypertensjon og metabolske syndromer.
Det er rapporter som sørger for at plasmakonsentrasjonen av adiponektin reduseres hos pasienter som lider av patologiske tilstander som insulinresistens og fedme..
Referanser
- Chandran, M., Phillips, S. A., Ciaraldi, T., og Henry, R. R. (2003). Adiponectin: mer enn bare nok et fettcellehormon? Diabetesomsorg, 26 (8), 2442-2450.
- Hirako, S. (2016). Adiponectin. I Håndbok om hormoner (s. 308-e34B). Akademisk presse.
- Kadowaki, T. og Yamauchi, T. (2005). Adiponectin og adiponectin reseptorer. Endokrine vurderinger, 26 (3), 439-451.
- Kadowaki, T., Yamauchi, T., Kubota, N., Hara, K., Ueki, K., & Tobe, K. (2006). Adiponectin og adiponectin reseptorer i insulinresistens, diabetes og metabolsk syndrom. The Journal of clinical investigation, 116 (7), 1784-1792.
- Klein, S., og Romijn, J. A. (2007). Kapittel 35 - Fedme. Williams lærebok for endokrinologi, 11, 1568-1569.
- Steyn, F. J., & Chen, C. (2013). Adiponectin.


Ingen har kommentert denne artikkelen ennå.