
LIA Agar (Lysine Iron) bakgrunn, tilberedning og bruk
De LIA agar (Iron Lysine) er en biokjemisk test som brukes til å identifisere bakterier av Enterobacteriaceae-familien. Dette mediet ble opprettet av Edwards og Fife, basert på Falkow-formelen.
Opprinnelig var denne testen en buljong som inneholder peptoner, gjærekstrakt, glukose, L-lysin, bromkresollilla og destillert vann. Edwards og Fife tilsatte agar-agar, jernammoniumcitrat og natriumtiosulfat..
Testen består i utgangspunktet av å demonstrere tilstedeværelsen av enzymet lysindekarboxylase, som er i stand til å reagere med karboksylgruppen i aminosyren L-lysin. En deaminering av aminosyren kan også forekomme på grunn av tilstedeværelsen av enzymet lysindeaminase..
I tillegg tillater sammensetningen av mediet bevis på at noen bakterieslekters evne til å produsere hydrogensulfid. Til slutt er det også mulig å observere generering av eller ikke gass i mediet.
Artikkelindeks
- 1 Begrunnelse
- 1.1 Peptoner og gjærekstrakt
- 1.2 Glukose
- 1.3 L-lysin
- 1,4 pH-indikator (bromokresol lilla)
- 1,5 Ferriammoniumcitrat og natriumtiosulfat
- 2 Tolkning av testen
- 2.1 Dekarboksylering av lysin
- 2.2 Deaminering av lysin
- 2.3 Produksjon av hydrogensulfid (H2S)
- 3 Resultatregistrering
- 4 Klargjøring
- 5 bruksområder
- 6 Referanser
Basis
Peptoner og gjærekstrakt
Som de fleste kulturmedier inneholder lysinjernagar komponenter som gir kilden til næringsstoffer som er nødvendige for bakterievekst. Disse komponentene er representert av peptoner og gjærekstrakt.
Glukose
Likeledes inneholder denne agaren glukose som et gjærbart karbohydrat. Alle bakterier i Enterobacteriaceae-familien er kjent for å gjære glukose.
Dette trinnet er avgjørende, fordi det vil være ansvarlig for forsuring av mediet, en viktig betingelse for at enzymet lysindekarboksylase - hvis det er til stede - virker på substratet..
I noen bakterieslekt kan man se gassproduksjon på grunn av glukosefermentering.
Gassen påvises når det er en forskyvning av agaren i røret, og etterlater et tomt rom i bunnen av røret, eller ved brudd på mediet i to eller flere deler.
L-lysin
Når lysin er dekarboksylert, dannes et diamin (kadaverin) og karbondioksid.
Dekarboksylering skjer i nærvær av pyridoksalfosfatkoenzym. Denne reaksjonen er irreversibel.
PH-indikator (bromokresol lilla)
Alle pH-endringene som oppstår i mediet på grunn av de forskjellige reaksjonene blir oppdaget av den lilla bromkresol-pH-indikatoren..
I denne forstand blir mediet gul når det er forsuring, og når det er alkalisering, går mediet tilbake til sin opprinnelige lilla eller lilla farge..
Når deaminering av lysin oppstår på grunn av tilstedeværelsen av enzymet lysindeaminase, dannes en rødlig farge på overflaten, typisk i slektene Proteus, Providencia og noen arter av Morganella.
Dette skyldes at alfa-keto-karbonsyre dannes under deamineringsprosessen, som reagerer med ammoniumcitrat i nærvær av oksygen og forårsaker den ovennevnte fargen..
Ferriammoniumcitrat og natriumtiosulfat
På den annen side vil bakterier som produserer hydrogensulfid bevises ved tilstedeværelse av natriumtiosulfat (svovelkilde) og jernammoniumcitrat, som er utvikleren av HtoS.
Bakterier som har enzymet tiosulfatreduktase har evnen til å handle ved å redusere det tilstedeværende natriumtiosulfatet og danne sulfitt og hydrogensulfid (HtoS).
Sistnevnte er en fargeløs gass, men når den reagerer med jernsaltet danner den jernholdig metallisk sulfid, som er en uoppløselig forbindelse (synlig sort bunnfall).
Imidlertid er dannelseskapasiteten til HtoS med dette mediet er ikke veldig pålitelig, fordi noen lysindekarboksylase-negative bakterier som er i stand til å produsere HtoS vil ikke danne det svarte bunnfallet, da surheten til mediet forstyrrer. Derfor anbefales det å sjekke med andre medier som inneholder jern.
Tolkning av testen
Lysindekarboksylering
Rørene bør leses etter 24 timers inkubasjon, ellers er det en risiko for å feiltolke reaksjonen og rapportere falske negativer..
Det må huskes at den første reaksjonen som vil oppstå, vil være gjæringen av glukose, derfor blir alle rørene etter 10 til 12 timer gule..
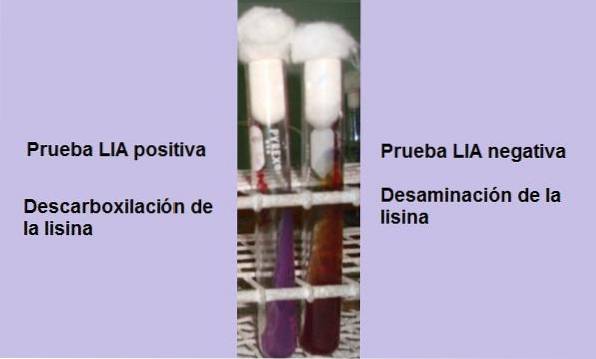
Hvis det på slutten av inkubasjonstiden (24 timer) observeres en gul bakgrunn med en lilla eller lilla overflate, er reaksjonen negativ. Den lilla fargen på overflaten tilsvarer alkaliseringen av mediet ved bruk av peptoner.
En positiv reaksjon er en der bunnen og overflaten av røret er helt lilla, det vil si at den går tilbake til den opprinnelige fargen..
Derfor, hvem som bestemmer positiviteten til testen, er basen eller bakgrunnen til mediet. Hvis du er i tvil om fargen, kan den sammenlignes med et ikke-inokulert LIA-rør.
Deaminering av lysin
Et rør som viser lysindeaminering vil ha en rødaktig rødbrun overflate og en gul (syre) bakgrunn, eller hele røret vil ha en rødaktig rødbrun farge..
Denne reaksjonen tolkes som negativ for lysindekarboksylering, men positiv for lysindeaminering..
Denne reaksjonen er definert og tolket på rammen.
Produksjon av hydrogensulfid (HtoS)
En positiv reaksjon observeres ved utseendet til et svart bunnfall i hele eller deler av mediet. Vanligvis mellom kanten av fasingen og underlaget.
Hvis bunnfallet oppstår gjennom røret, vil det ikke vise de andre reaksjonene som oppstår i midten..
Registrering av resultater
Når du tolker testen, blir resultatene registrert som følger:
Rammen leses først, deretter bunnen eller blokken, deretter produksjonen av HtoJa, og til slutt gassproduksjon.
Eksempel: K / A + (-). Dette betyr:
- K: Alkalisk ramme (lilla farge)
- A: Sur bakgrunn (gul), dvs. negativ dekarboksyleringsreaksjon og negativ deaminering.
- +: Produksjon av hydrogensulfid
- (-): Uten gass.
Forberedelse
Vei 35 g av dehydrert jernagarlysinmedium og oppløs i en liter destillert vann..
Varm opp til agaren er fullstendig oppløst. La den koke i et minutt under omrøring ofte. Fordel 4 ml av mediet i 13/100 reagensglass med bomullshetter.
Steriliser i en autoklav ved 121 ° C i 15 minutter. Fjern fra autoklaven og la den stå i en vinkel, slik at det er en dyp base og en kort skråkant.
Oppbevares i kjøleskap 2-8 ° C. La det varme opp før du sår bakteriestammen.
Det dehydratiserte mediet er beige og det tilberedte mediet er rødlilla..
Den endelige pH-verdien til det tilberedte mediet er 6,7 ± 0,2
Mediet blir gult med pH lik eller mindre enn 5,2, og er lilla ved pH 6,5 og over.
applikasjoner
Denne testen, sammen med andre biokjemiske tester, brukes til å identifisere basiller av Enterobacteriaceae-familien..
Mediet blir sådd med en rett løkke eller nål, en eller to punkteringer blir laget på bunnen av røret, og deretter blir overflaten av mediet skåret i en sikksakk..
Inkuber i 24 timer ved 35-37 ° C i aerobiose. Inkuber om nødvendig i ytterligere 24 timer..
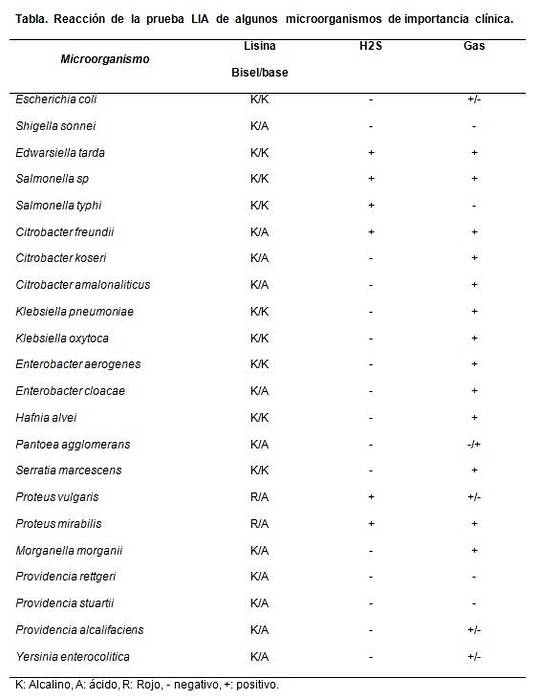
Det er hovedsakelig nyttig å skille laktose-negative Citrobacter-arter fra Salmonellas sp.
Referanser
- Mac Faddin J. (2003). Biokjemiske tester for identifisering av bakterier av klinisk betydning. 3. utg. Redaksjonell Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12. utg. Redaksjonell Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. utg. Redaksjonell Panamericana S.A. Argentina.
- Britannia Laboratories. Lysinjernagar. 2015. Tilgjengelig på: britanialab.com
- BD Laboratories. BBL Lysine Iron Agar Slants. 2007. Tilgjengelig på: bd.com
- Valtek Laboratories. Midt L.I.A. 2009. Tilgjengelig på: andinamedica.com

Ingen har kommentert denne artikkelen ennå.