
Aufbau prinsippkonsept og forklaring, eksempler
De Aufbau-prinsippet Den består av en nyttig guide for teoretisk å forutsi den elektroniske konfigurasjonen av et element. Ordet aufbau refererer til det tyske verbet "å bygge." Reglene diktert av dette prinsippet er ment å "bidra til å bygge atomet".
Når vi snakker om den hypotetiske atomkonstruksjonen, refererer den utelukkende til elektroner, som igjen går hånd i hånd med det økende antall protoner. Protoner definerer atomnummer Z til et kjemisk element, og for hver som legges til kjernen tilsettes et elektron for å kompensere for denne økningen i positiv ladning..
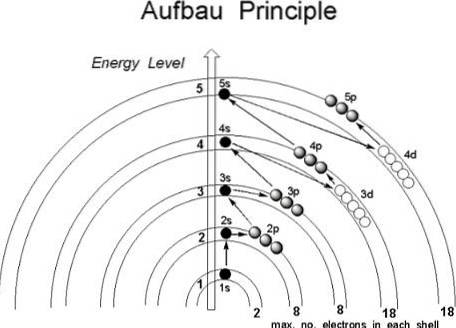
Selv om det ser ut til at protonene ikke følger en etablert rekkefølge for å bli med i atomkjernen, følger elektronene en rekke forhold, på en slik måte at de først okkuperer atomområdene med lavere energi, spesielt de der sannsynligheten for å finne dem i rommet er større: orbitalene.
Aufbau-prinsippet, sammen med andre elektroniske fyllingsregler (Pauli-ekskluderingsprinsippet og Hunds regel), hjelper til med å etablere rekkefølgen elektroner skal legges til i elektronskyen; på denne måten er det mulig å tilordne en riktig elektronisk konfigurasjon av et bestemt kjemisk element.
Artikkelindeks
- 1 Konsept og forklaring
- 1.1 Lag og underlag
- 1.2 Paulis utelukkelsesprinsipp og Hunds regel
- 2 Eksempler
- 2.1 Karbon
- 2.2 Oksygen
- 2.3 Kalsium
- 3 Begrensninger i Aufbau-prinsippet
- 4 Referanser
Konsept og forklaring
Hvis atomet ble ansett som om det var en løk, ville det finnes et endelig antall lag i det, bestemt av hovedkvantetallet n.
Videre, i dem, er subshellene, hvis former avhenger av kvantetallene azimuthal l og magnetisk m.
Orbitalene identifiseres av de første tre kvantetallene, mens den fjerde, spinnene, ender med å indikere i hvilken bane elektronet vil være plassert. Det er da i disse områdene av atomet der elektronene roterer, fra det innerste til det ytterste laget: valenslaget, det mest energiske av alle..
Dette er tilfelle, i hvilken rekkefølge skal elektronene fylle orbitalene? I henhold til Aufbau-prinsippet, bør de tildeles basert på den økende verdien (n + l).
Likeledes må elektronene inne i subshellene (n + l) okkupere subshell med den laveste energiværdien; med andre ord, de opptar den laveste verdien av n.
Etter disse konstruksjonsreglene utviklet Madelung en visuell metode som består i å tegne diagonale piler, som hjelper til med å bygge den elektroniske konfigurasjonen til et atom. På noen pedagogiske områder er denne metoden også kjent som regnmetoden..
Lag og underlag
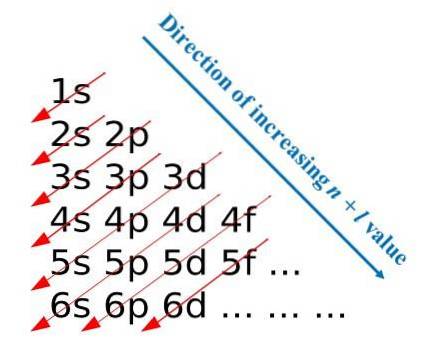
Det første bildet illustrerer en grafisk metode for å oppnå elektronkonfigurasjonene, mens det andre bildet er den respektive Madelung-metoden. De mest energiske lagene er plassert på toppen og de minst energiske er i en nedadgående retning..
Fra venstre til høyre blir underlagene s, p, d og f av deres tilsvarende hovedenerginivåer "transitt". Hvordan beregner jeg verdien av (n + l) for hvert trinn markert med diagonale pilene? For eksempel for 1s orbital er denne beregningen lik (1 + 0 = 1), for 2s orbital (2 + 0 = 2), og for 3p orbital (3 + 1 = 4).
Resultatet av disse beregningene stammer fra konstruksjonen av bildet. Derfor, hvis den ikke er tilgjengelig for hånden, kan du bare bestemme (n + l) for hver bane, og begynne å fylle orbitalene med elektroner fra den med den laveste verdien på (n + l) til den med den maksimale verdien.
Bruk av Madelung-metoden letter imidlertid konstruksjonen av elektronkonfigurasjonen og gjør det til en underholdende aktivitet for de som lærer det periodiske systemet..
Paulis utelukkelsesprinsipp og Hunds regel
Madelung-metoden indikerer ikke underhyllenes orbitaler. Når man tar dem i betraktning, sier utelukkelsesprinsippet Pauli at ingen elektroner kan ha samme kvantetall som et annet; eller hva er det samme, et par elektroner kan ikke ha både positive eller negative spinn.
Dette betyr at deres spinnkvantantall s ikke kan være like, og derfor må spinnene deres pares når de opptar samme bane.
På den annen side må utfyllingen av orbitalene gjøres på en slik måte at de blir utartet i energi (Hunds regel). Dette oppnås ved å holde alle elektronene i orbitalene uparret, til det er strengt nødvendig å parre et par av disse (som med oksygen).
Eksempler
Følgende eksempler oppsummerer hele konseptet med Aufbau-prinsippet..
Karbon
For å bestemme den elektroniske konfigurasjonen, må atomnummeret Z først være kjent, og dermed antall elektroner. Karbon har Z = 6, så de 6 elektronene må være plassert i orbitalene ved hjelp av Madelung-metoden:

Pilene tilsvarer elektronene. Etter å ha fylt 1s og 2s orbitalene, hver med to elektroner, tildeles 2p orbitalene med forskjell de resterende to elektronene. Hunds regel manifesteres altså: to degenererte orbitaler og en tom.
Oksygen

Oksygen har Z = 8, så det har to ekstra elektroner i motsetning til karbon. En av disse elektronene må plasseres i den tomme 2p orbitalen, og den andre må pares for å danne det første paret, med pilen pekende nedover. Følgelig manifesteres Pauli-utelukkelsesprinsippet.
Kalsium
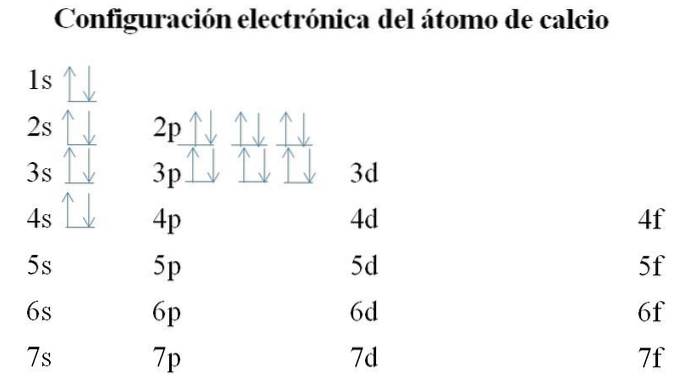
Kalsium har 20 elektroner, og orbitalene er fortsatt fylt med samme metode. Fyllingsrekkefølgen er som følger: 1s-2s-2p-3s-3p-4s.
Det kan bemerkes at i stedet for å fylle 3d-banen først, okkuperer elektronene 4-årene. Dette skjer før du legger til rette for overgangsmetaller, grunnstoffer som fyller det indre laget 3d.
Begrensninger i Aufbau-prinsippet
Aufbau's prinsipp unnlater å forutsi de elektroniske konfigurasjonene av mange overgangsmetaller og sjeldne jordartselementer (lanthanider og aktinider).
Dette er fordi de energiske forskjellene mellom ns og (n-1) d orbitaler er lave. Av grunner støttet av kvantemekanikk, kan elektroner foretrekke å degenerere (n-1) d-orbitalene på bekostning av å angre eller løsne elektroner fra ns-orbitalen.
Et kjent eksempel er tilfellet kobber. Dens elektronkonfigurasjon forutsagt av Aufbau-prinsippet er 1sto2sto2 s63sto3p64sto3d9, når det eksperimentelt har vist seg å være 1sto2sto2 s63sto3p64s13d10.
I den første er et enslig elektron paret i en 3d-bane, mens i det andre er alle elektronene i 3d-orbitalene paret..
Referanser
- Helmenstine, Anne Marie, Ph.D. (15. juni 2017). Aufbau prinsippdefinisjon. Hentet fra: thoughtco.com
- Prof. N. De Leon. (2001). Aufbau-prinsippet. Hentet fra: iun.edu
- Kjemi 301. Aufbau-prinsipp. Hentet fra: ch301.cm.utexas.edu
- Hozefa Arsiwala og teacherlookup.com. (1. juni 2017). I dybden: Aufbau-prinsipp med eksempler. Hentet fra: teacherlookup.com
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Learning, s 199-203.
- Goodphy. (27. juli 2016). Ordning av Madelung. [Figur]. Hentet fra: commons.wikimedia.org



Ingen har kommentert denne artikkelen ennå.