
Borax historie, struktur, egenskaper, bruksområder, syntese, risiko
De boraks eller natriumborat er en betegnelse for en gruppe kjemiske forbindelser med en baseformel av NatoB4ELLER7. Det er et hygroskopisk salt som er i stand til å danne mange hydrater, i tillegg til å være strukturelt beriket av tilstedeværelsen av visse metalliske urenheter..
Hovedforbindelsene som får navnet boraks er følgende: vannfritt natriumtetraborat, NatoB4ELLER7; natriumtetraborat pentahydrat (NatoB4ELLER7) .5HtoELLER; og natriumtetraboratdekahydrat, NatoB4ELLER7.10HtoEller, eller dets tilsvarende, natriumtetraboratoktahydrat, NatoB4ELLER5(ÅH)4.8HtoELLER.

Som det kan forstås, skiller alle ovennevnte faste stoffer seg bare i deres hydratiseringsgrad; noen har flere vannmolekyler i krystallene enn andre. Fysisk ser boraks ut som solide biter eller krystaller av kritt (toppbilde).
Borax finnes naturlig i sesongbaserte innsjøsedimenter, tørket av fordampning. Borax produseres i Tyrkia, Searles Lakes (California), i Atacama-ørkenen, Chile, Bolivia, Tibet og Romania. Borax-krystaller kan oppnås syntetisk ved en langsom kjerneprosess; det vil si en der veksten av krystaller er favorisert.
Natriumtetraborat, vannfritt og dekahydratert, er lite løselig i kaldt vann; men dets løselighet øker med temperaturøkning. Deretter entoB4ELLER7.10HtoEller det er veldig løselig i etylenglykol, moderat løselig i etanol og lett løselig i aceton; disse er mindre polare løsemidler enn vann.
Borax har en rekke bruksområder, for eksempel ved fremstilling av vaskemidler og såper; som et brannhemmende middel for cellulosemateriale; i produksjon av glassfiber; ved rengjøring av harde overflater som metaller, glass og keramikk; og i hemming av korrosjon, blant andre bruksområder.
Borax irriterer øynene, huden og luftveiene. Ved svelging kan det blant annet gi oppkast, diaré, slapphet, forfall og kramper. For tiden mistenkes det at det kan ha skadelige effekter på reproduksjon av mennesker.
Artikkelindeks
- 1 Historie
- 2 Struktur av boraks
- 3 krystaller
- 3.1 Forvekslinger med boratanionet
- 4 eiendommer
- 4.1 Navn
- 4.2 Molekylær masse
- 4.3 Fysisk utseende
- 4.4 Tetthet
- 4.5 Smeltepunkt
- 4.6 Kokepunkt
- 4.7 Løselighet i vann
- 4.8 Løselighet i organiske løsningsmidler
- 4.9 Brytningsindeks (ηD)
- 4.10 Stabilitet
- 4.11 Lysutslipp
- 4.12 Reaksjoner
- 5 bruksområder
- 5.1 Antioksidant handling
- 5.2 Produksjon av lim
- 5.3 Brannhemmende
- 5.4 Produksjon av borosilikatglass (Pyrex)
- 5.5 Emulgator
- 5.6 Rengjøringsmateriell
- 5.7 Medisinske bruksområder
- 5,8 pH-buffer
- 5.9 Reduksjon i vannhardhet
- 5.10 Gjødsel og kompost
- 5.11 Trebeskyttelse
- 5.12 Flux og flux
- 5.13 Andre
- 6 Syntese
- 7 Risiko
- 8 Referanser
Historie
Historien om boraks er forvirrende. Det sies at det ble oppdaget i sengen til en innsjø i Tibet, tørket opp av fordampning. Den ble overført på 800-tallet fra Tibet til Saudi-Arabia, etter den såkalte Silk Road.
Begrepet "boraks" ble populært som et resultat av de mange applikasjonene som ble funnet og markedsført under navnet 20 Mule Team Borax Tradermax, som refererte til måten borax ble transportert gjennom ørkenene i Nevada og California.
En annen versjon av oppdagelsen indikerer at egypterne visste om dens eksistens i lang tid, og brukte den til sveising av metaller med varme. I tillegg brukte de det i medisin og i mumifiseringsprosessen. Borax ble overført til Europa på 1200-tallet av Marco Polo.
På midten av 1800-tallet ble store avleiringer av boraks oppdaget i Mogave-ørkenen, som har gjort bruken vanlig siden den gang..
Struktur av boraks

Det øvre bildet viser ionene som utgjør boraks, spesielt tilsvarer et fast stoff med en sammensetningsformel av Nato[B4ELLER5(ÅH)4] · 8HtoO (eller NatoB4ELLER710HtoELLER).
For det første burstrukturen til anionet [B4ELLER5(ÅH)4]to- (selv om den skulle ha to deprotonerte -OH-grupper, -O-), hvor en åttekantet ring (fire B- og fire O-atomer) kan sees, med en B-O-B-bro som deler den i to halvdeler.
Nevnte bur forblir ikke statisk, men vibrerer og antar forskjellige former i rommet; imidlertid i mindre grad i nærheten av broen. Det kan også merkes at den er veldig "oksygenert"; det vil si at den har mange oksygenatomer som er i stand til å samhandle med vannmolekyler gjennom hydrogenbindinger.
Det er ikke overraskende at boraks-krystaller kan hydrere og generere mange hydrater. Således, for det faste Nato[B4ELLER5(ÅH)4] · 8HtoEller det er åtte molekyler av HtoEller samhandle med boratburet, og samtidig med metallsentrene i Na+.
På kationesiden har vi det vandige komplekset [Na (HtoELLER)4]+n, hvor verdien av n vil avhenge av anion / kation-forholdet. I det øvre faste stoffet, n = 2, har vi: [Nato(HtoELLER)8]to+, hvis 2+ ladning nøytraliserer 2- ladningen av boratanionen.
Krystaller
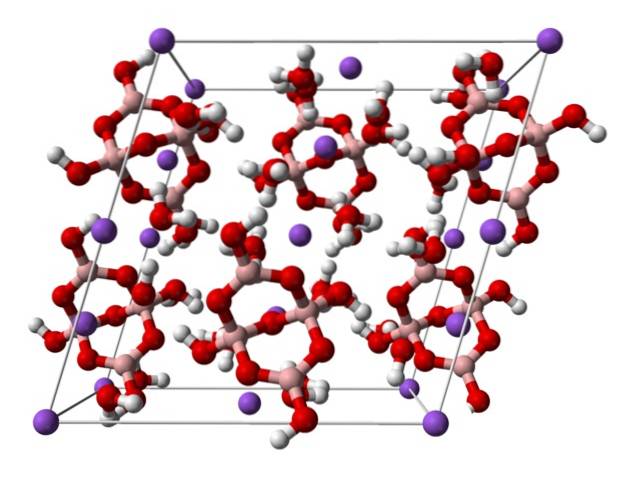
domene].
Ovenfor er den monokliniske enhetscellen for Na-krystallerto[B4ELLER5(ÅH)4] · 8HtoO eller NatoB4ELLER710HtoO. Her styrer eller dominerer elektrostatiske attraksjoner og hydrogenbindinger de strukturelle mønstrene som stammer fra hvert krystallspenn..
De andre hydratene og det vannfrie saltet mister ett eller alle vannmolekylene, og endrer sammensetningen og strukturen til boraks-krystallet. I alle av dem forblir anion og kation det samme (med mindre det er urenheter eller bivirkninger), så det kan ikke være noen forvirring i denne forbindelse..
Forvirringer med boratanionet
Nato[B4ELLER5(ÅH)4] · 8HtoO og NatoB4ELLER710HtoEller de er de samme. Hvorfor?
For det første, hvis du teller atomene, vil det sees at de sammenfaller i antall; og for det andre i anionet B4ELLER7to- fraværet av de to OH-gruppene knyttet til borhodene til B-O-B-broene blir vurdert; to OH som sammen med de to H+ kommer fra B4ELLER7to-, legg til 2 HtoEller gir totalt 10 HtoEller (8 + 2).
Eiendommer
Navn
- Borax.
- Natriumborat.
- Natriumtetraborat.
- Dinatriumtetraborat.
Molekylær masse
Vannfri: 201,22 g / mol.
Dekahydrat: 381,38 g / mol.
Fysisk utseende
Et hvitt krystallinsk fast stoff.
Tetthet
Vannfri: 2,4 g / cm3
Dekahydrat: 1739 g / cm3
Smeltepunkt
Vannfri: 743 ºC (1.369 ºF, 1.016 K).
Dekahydrat: 75 ºC.
Kokepunkt
Vannfri: 1.575 ºC (2.867 ºF, 1.848 K).
Vannløselighet
31,78 g / L (for både vannfritt og dekahydrat).
Løselighet i organiske løsningsmidler
Den er veldig løselig i etylenglykol, moderat løselig i dietylenglykol og metanol, og lett løselig i aceton..
Brytningsindeks (ηD)
Vannfri: η1 = 1447; ηto = 1469.
Dekahydrat: ηto = 1472.
Stabilitet
Den er stabil under riktig lagringsforhold. Selv om det har et lavt damptrykk, øker det med temperaturen, noe som fører til krystallisering og kondens, så store svingninger i temperatur og fuktighet bør unngås..
Lysutslipp
Natriumtetraborat avgir grønt lys når det utsettes for ild.
Reaksjoner
- Når den oppløses i vann, produserer den alkaliske løsninger med en pH på rundt 9,2.
- Borax reagerer og danner andre borater, som perborat (PBS).
- Det produserer også borsyre ved å reagere med saltsyre:
NatoB4ELLER710HtoO + HCl => 4 H3BO3 + 2 Na+ + 2 Cl- + 5 timertoELLER
- Natriumtetraborat oppfører seg som et amfotert stoff, siden det i vandig løsning hydrolyserer og er i stand til å nøytralisere syrer. På samme måte er den i stand til å nøytralisere alkalier med høy konsentrasjon, og unngå en overdreven økning i mediumets pH..
applikasjoner
Borax har mange bruksområder, både hos mennesker og i alle aktiviteter de utfører..
Antioksidant handling
Borax har evnen til å oppløse oksider. Av denne grunn brukes den til gjenvinning av metaller som messing, kobber, bly og sink..
Det brukes også til å forhindre oksidasjon av metallstenger i støperier. Borax dekker overflaten, unntatt luft, og forhindrer derfor oksidasjon. I tillegg forhindrer det korrosjon av jernholdig materiale i bilindustrien.
Løseligheten av boraks i etylenglykol har vært nyttig i frostvæskeformuleringer. Borax nøytraliserer de sure restene som produseres under spaltning av etylenglykol, og minimerer oksidasjonen som overflaten til metaller kan gjennomgå.
Produksjon av lim
- Borax er en del av en stivelseslimformulering for bølgepapir og papp.
- Det er et peptiserende middel ved fremstilling av lim basert på kasein og dekstrin.
- Det fungerer ved å styrke limmaterialer gjennom tverrbinding av konjugerte hydroksylgrupper.
Brannhemmende
Det brukes som et brannhemmende middel i cellulosematerialer og andre polymerer som inneholder hydroksylgrupper. Den utøver sin handling gjennom forskjellige mekanismer, inkludert dannelse av et glasslegemet som begrenser tilgangen til drivstoff.
Produksjon av borosilikatglass (Pyrex)
Borax er en kilde til bor som brukes ved fremstilling av borosilikatglass; preget av høyt smeltepunkt, lav ekspansjonskoeffisient og høy motstand mot termisk støt.
Dette gjør at den kan utsettes for høye temperaturer uten å oppleve brudd, og motta navnet på ildfast glass..
Borosilikatglass brukes til fremstilling av materialer som skal brukes i hjemmet til å bake mat. Den brukes også i laboratorier i beger, kolber, målesylindere, pipetter, etc..
Emulgator
Borax, sammen med andre forbindelser, brukes til å emulgere såper og andre parafiner. Det brukes også som en base for produksjon av kremer, kremer og salver..
Vaskemidler
- Det tilsettes i formuleringer for å rengjøre faste overflater som metaller, glass og keramikk.
- Den brukes i håndrengjøringsmidler, poleringsmaterialer og vaskemiddel såper for bruk i vaskerier og hjemme. I tillegg letter det fjerning av oljeavsetninger fra fabrikkgulv.
Medisinsk bruk
- Den brukes til behandling av soppinfeksjoner i føttene.
- Det er en del av formelen for næringsstoffer som leverer bor. Dette elementet antas å være involvert i metabolismen av kalsium, fosfor og magnesium, og kan være nødvendig for beinstruktur.
- Det er involvert i bestemmelsen av glykosylert hemoglobin (HbA1C), en test som tjener til å bestemme den langsiktige utviklingen av diabetes hos en pasient, siden halveringstiden til en erytrocytt er 120 dager..
Denne informasjonen er mer nyttig for klinikeren enn individuelle blodsukkermålinger fra pasienten..
PH-buffer
Den brukes i forskjellige buffersystemer som brukes i biokjemi; blant dem, Tris (hydroksymetyl) aminometanborat, brukt i polyakrylamidelektroforese av DNA og RNA-nukleinsyrer.
Reduksjon i vannhardhet
Borax er i stand til å kombinere med kalsium- og magnesiumionene som er tilstede i vann, og redusere konsentrasjonen. På denne måten reduseres vannets hardhet.
Gjødsel og kompost
Borax brukes som kilde til bor. Kalsium og bor er involvert i dannelsen av plantecelleveggen. I tillegg er det blitt påpekt at bor favoriserer pollinering, og det er derfor det griper inn i gjødsling og spredning av planter.
Trebeskyttelse
Borax bekjemper treorm, en bill som forbruker og ødelegger tre. Den brukes også til bevaring og vedlikehold av trebåter.
Flux og flux
Det brukes som en strøm i sveisingen av stål og jern, forårsaker en reduksjon i smeltepunktet og eliminering av jernoksid; en uønsket forurensning. For et lignende formål deltar han i lodding av gull og sølv.
Andre
- Det brukes som et mildt plantevernmiddel; for eksempel å bekjempe møll på ull.
- Sprøyting brukes til bekjempelse av skadedyr som er tilstede i skap, innvendige tanker, i hullene på veggene, og generelt, der bruk av mer forurensende plantevernmidler ikke er ønsket..
- Den brukes i atomreaktorer for å kontrollere reaksjoner som i ekstreme tilfeller kan gi en kjedereaksjon.
- I bilradiatorer brukes boraks til å blokkere steder der det er vannlekkasjer.
Syntese
Borax oppnås ved å omsette mineralet ulexitt, sammensatt av elementene bor, natrium og kalsium, med formelen NaCaB5ELLER9.8HtoEller med natriumkarbonat og natriumhydrokarbonat i vandig medium.
Faktisk er syntesen av natriumtetraborat eller boraks lite brukt; det meste av den produserte forbindelsen oppnås ved ekstraksjon av mineralene som inneholder den.
Prosessen kan oppsummeres i en oppløsning av malmen i vann, etterfulgt av en filtrering i leire og til slutt en fordampning av den vandige løsningen.
Risiko
Borax er et naturlig produkt, men det kan forårsake en rekke skader på menneskers helse. Kontakt med boraxpulver kan for eksempel forårsake hudirritasjon som kan føre til dermatitt..
På samme måte forårsaker boraks irritasjon i øynene og øvre luftveier. Symptomer på innånding inkluderer hoste og ondt i halsen.
I mellomtiden presenterer inntaket av boraks følgende symptomer: oppkast, kvalme, diaré, slapphet, hodepine og kramper. I tillegg kan sentralnervesystemet og nyrefunksjonen påvirkes..
Fra studier utført på hannrotter, matet med boraks, ble testikkelatrofi observert hos dem. Mens studier som ble utført med gravide hunnrotter, indikerte at boraks kunne krysse morkaken og produsere en endring av fosterutviklingen, manifestert av lav fødselsvekt.
Eksponering for boraks antas å påvirke mannlig reproduksjonsfunksjon hos menn, manifestert av en reduksjon i sædtal.
En dødelig dose på 10 til 25 gram er estimert for boraksinntak hos voksne.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Nasjonalt senter for bioteknologisk informasjon. (2019). Argon. PubChem-database. CID = 23968. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Karolyn Burns, Seneca Joseph og Dr. Ryan Baumbach. (s.f.). Syntese og egenskaper av Borax-krystaller og intermetalliske legeringer. Gjenopprettet fra: nationalmaglab.org
- Wikipedia. (2019). Borax. Gjenopprettet fra: en.wikipedia.org
- Rio Tinto. (2019). Borax dekahydrat. 20 Mule Team Borax. Gjenopprettet fra: borax.com
- Fletcher Jenna. (14. januar 2019). Er borax trygt å bruke? Gjenopprettet fra: medicalnewstoday.com



Ingen har kommentert denne artikkelen ennå.