
Aluminiumbromidformel, egenskaper og bruksområder
De aluminiumbromid Det er en forbindelse som består av et aluminiumatom og et variert antall bromatomer. Den dannes avhengig av antall valenselektroner som aluminium har.
Å være en forbindelse forbundet med et metall (aluminium) og et ikke-metall (brom), dannes kovalente bindinger som gir strukturene en veldig god stabilitet, men uten å nå den til en ionisk binding..
Aluminiumbromid er et stoff som normalt forekommer i fast tilstand, med en krystallinsk struktur.
Fargene på de forskjellige aluminiumbromidene fremstår som bleke gule i forskjellige nyanser, og noen ganger vises de uten tilsynelatende farge.
Fargen avhenger av lysrefleksjonskapasiteten til forbindelsen og endres avhengig av strukturene som opprettes og formene den tar..
Den faste tilstanden til disse forbindelsene krystalliserer, så de har veldefinerte strukturer med et utseende som ligner på havsalt, men varierer i farger..
Formel
Aluminiumbromid består av et aluminiumatom (Al) og forskjellige mengder bromatomer (Br), avhengig av valenselektronene som aluminium har..
Av denne grunn kan den generelle formelen for aluminiumbromid skrives som følger: AlBrx, hvor "x" er antall bromatomer som binder seg til aluminium.
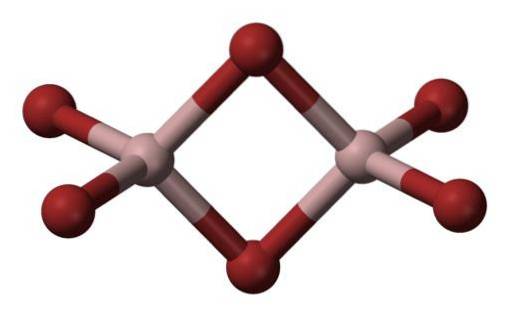
Den vanligste formen den forekommer i er som Al2Br6, som er et molekyl med to aluminiumatomer som hovedbaser i strukturen..
Bindingen mellom dem er dannet av to brominer i midten, slik at hvert aluminiumatom har fire bromatomer i sin struktur, men i sin tur deler de to.
Eiendommer
På grunn av sin natur er den svært løselig i vann, men den er også delvis løselig i forbindelser som metanol og aceton, i motsetning til andre typer stoffer..
Den har en molekylvekt på 267 g / mol og dannes av kovalente bindinger.
Natriumbromid når kokepunktet ved 255 ° C og når smeltepunktet ved 97,5 ° C.
En annen egenskap ved denne forbindelsen er at den avgir giftstoffer når den fordamper, så det anbefales ikke å jobbe med den ved høye temperaturer uten tilstrekkelig beskyttelse og relevant sikkerhetskunnskap..
applikasjoner
En av bruksområdene som er gitt til denne typen stoffer på grunn av dets metalliske og ikke-metalliske natur, er at agenter i kjemiske renhetstester..
Renhetstesting er veldig viktig for å bestemme kvaliteten på reagenser og lage produkter som folk er fornøyd med..
I vitenskapelig forskning brukes den på en veldig variabel måte. For eksempel for å danne komplekse strukturer, midler i syntesen av andre verdifulle kjemiske produkter, i hydrogeneringen av dihydroksynaftalener og i selektiviteten i reaksjoner, blant andre bruksområder..
Denne forbindelsen er ikke kommersielt populær. Som sett ovenfor, har den noen applikasjoner som er veldig spesifikke, men veldig interessante for det vitenskapelige samfunnet..
Referanser
- Chang, R. (2010). Kjemi (10. utgave) McGraw-Hill Interamericana.
- Krahl, T., og Kemnitz, E. (2004). Amorf aluminiumbromidfluorid (ABF). Angewandte Chemie - Internasjonal utgave, 43(48), 6653-6656. doi: 10.1002 / anie.200460491
- Golounin, A., Sokolenko, V., Tovbis, M., & Zakharova, O. (2007). Komplekser av nitronaftoler med aluminiumbromid. Russian Journal of Applied Chemistry, 80(6), 1015-1017. doi: 10.1134 / S107042720706033X
- Koltunov, K. Y. (2008). Kondensering av naftalendioler med benzen i nærvær av aluminiumbromid: En effektiv syntese av 5-, 6- og 7-hydroksy-4-fenyl-1- og 2-tetraloner. Tetrahedron Letters, 49(24), 3891-3894. doi: 10.1016 / j.tetlet.2008.04.062
- Guo, L., Gao, H., Mayer, P., & Knochel, P. (2010). Fremstilling av organoaluminiumreagenser fra propargyliske bromider og aluminium aktivert av PbCl2 og deres regio- og diastereoselektive tillegg til karbonylderivater. Chemistry-a European Journal, 16(32), 9829-9834. doi: 10.1002 / chem.201000523
- Ostashevskaya, L. A., Koltunov, K. Y., og Repinskaya, I. B. (2000). Jonisk hydrogenering av dihydroksynaftalener med cykloheksan i nærvær av aluminiumbromid. Russian Journal of Organic Chemistry, 36(10), 1474-1477.
- Iijima, T. og Yamaguchi, T. (2008). Effektiv regioselektiv karboksylering av fenol til salisylsyre med superkritisk CO2 i nærvær av aluminiumbromid. Journal of Molecular Catalysis A: Chemical, 295(1-2), 52-56. doi: 10.1016 / j.molcata.2008.07.017
- Murachev, V. B., Byrikhin, V. S., Nesmelov, A. I., Ezhova, E. A., & Orlinkov, A. V. (1998). 1H NMR spektroskopisk studie av tert-butylklorid - kationisk initieringssystem av aluminiumbromid. Russian Chemical Bulletin, 47(11), 2149-2154.



Ingen har kommentert denne artikkelen ennå.