
Kalorimeterhistorie, deler, typer og deres egenskaper
De kalorimeter er en enhet som brukes til å måle temperaturendringen til en mengde stoff (vanligvis vann) med kjent spesifikk varme. Denne temperaturendringen skyldes varmen som absorberes eller frigjøres i prosessen som studeres; kjemisk hvis det er en reaksjon, eller fysisk hvis den består av en fase- eller tilstandsendring.
I laboratoriet er det enkleste kalorimeteret som finnes på kaffeglasset. Den brukes til å måle varmen som absorberes eller frigjøres i en reaksjon ved konstant trykk, i vandig løsning. Reaksjonene er valgt for å unngå intervensjon av reagenser eller gassformige produkter.
Mengden varme som avgis i reaksjonen = mengden varme absorbert av kalorimeteret + mengden varme absorbert av løsningen
Mengden varme som absorberes av kalorimeteret kalles kalorimeterets kapasitet. Dette bestemmes ved å tilføre en kjent mengde varme til kalorimeteret med en gitt vannmasse. Deretter øker temperaturen på kalorimeteret og løsningen som inneholder.
Med disse dataene, og bruken av den spesifikke varmen av vann (4,18 J / g.ºC), kan kalorimeterets kalorikapasitet beregnes. Denne kapasiteten kalles også kalorimeterkonstanten.
På den annen side er varmen som oppnås av den vandige løsningen lik m · ce · At. I formelen m = vannmasse, ce = spesifikk vannvarme og Δt = temperaturvariasjon. Når du vet alt dette, kan du beregne mengden varme som frigjøres av den eksoterme reaksjonen.
Artikkelindeks
- 1 Kalorimeterets historie
- 2 deler
- 3 Typer og deres egenskaper
- 3.1 Kaffeglasset
- 3.2 Den kalorimetriske bomben
- 3.3 Adiabatisk kalorimeter
- 3.4 Isoperibol kalorimeter
- 3.5 Strømningskalorimeter
- 3.6 Kalorimeteret for differensiell skanningskalorimetri
- 4 Søknader
- 4.1 I fysikkjemi
- 4.2 I biologiske systemer
- 4.3 Oksygenpumpens kalorimeter og kalorikraft
- 5 Referanser
Kalorimeterets historie
I 1780 brukte A. L. Lavoisier, en fransk kjemiker, ansett som en av kjemifedrene, et marsvin for å måle varmeproduksjonen ved åndedrett..
Hvordan? Bruke en enhet som ligner et kalorimeter. Varmen produsert av marsvinet ble påvist ved smeltingen av snøen som omgav apparatet.
Forskere A. L Lavoisier (1743-1794) og P. S. Laplace (1749-1827) designet et kalorimeter som ble brukt til å måle kroppens spesifikke varme ved hjelp av metoden for å smelte is.
Kalorimeteret besto av en sylindrisk, lakkert tinnkopp, støttet av et stativ og innvendig avsluttet med en trakt. Inne i det ble det plassert et annet glass, i likhet med det forrige, med et rør som krysset det ytre kammeret og som ble utstyrt med en nøkkel. Inne i det andre glasset var et rutenett.
Vesenet eller objektet hvis spesifikke varme skulle bestemmes ble plassert på dette rutenettet. Is ble plassert inne i de konsentriske brillene, som i kurven.
Varmen som produseres av kroppen ble absorbert av isen og fikk den til å smelte. Og det flytende vannproduktet fra smeltingen av isen ble samlet opp og åpnet den indre glasskranen.
Og til slutt, vannet veide, var massen av smeltet is kjent.
Deler
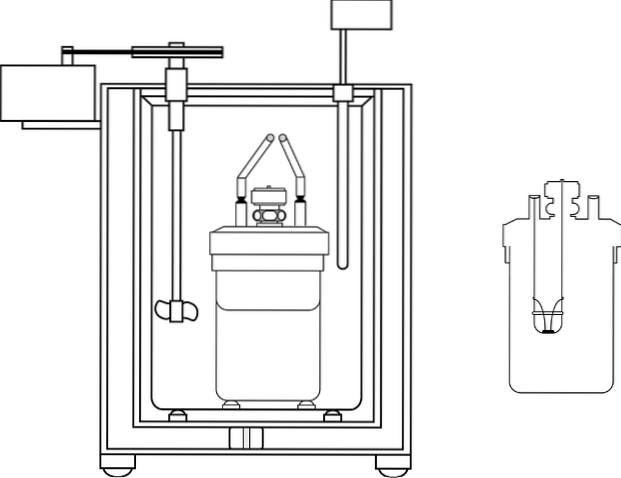
Det mest brukte kalorimeteret i laboratorier for kjemiundervisning er det såkalte kaffekoppkalorimeteret. Dette kalorimeteret består av et begerglass, eller i stedet en beholder med anime-materiale som har visse isolerende egenskaper. Inne i denne beholderen plasseres den vandige løsningen med kroppen som skal produsere eller absorbere varme.
Et lokk laget av isolasjonsmateriale med to hull er plassert på den øvre delen av beholderen. I det ene settes inn et termometer for å måle temperaturendringer, og i det andre en omrører, fortrinnsvis laget av glassmateriale, som oppfyller funksjonen med å flytte innholdet i den vandige løsningen..
Bildet viser delene av et bomberkalorimeter; Det kan imidlertid sees at den har termometeret og omrøreren, vanlige elementer i flere kalorimetre.
Typer og deres egenskaper
Koppen med kaffe
Det er den som brukes til å bestemme varmen som frigjøres ved en eksoterm reaksjon, og varmen absorbert i en endoterm reaksjon..
Videre kan den brukes til å bestemme kroppens spesifikke varme; det vil si mengden varme som et gram av stoffet trenger å absorbere for å øke temperaturen med en grad Celsius. .
Den kalorimetriske bomben
Det er en enhet hvor mengden varme som avgis eller absorberes i en reaksjon som oppstår ved konstant volum måles.
Reaksjonen foregår i en solid stålbeholder (pumpen), som er nedsenket i et stort volum vann. Dette holder vanntemperaturendringene små. Derfor antas det at endringene knyttet til reaksjonen måles ved konstant volum og temperatur..
Ovennevnte indikerer at det ikke gjøres noe arbeid når en reaksjon utføres i et bomberkalorimeter.
Reaksjonen starter med å levere strøm gjennom kabler koblet til pumpen.
Det adiabatiske kalorimeteret
Det er preget av å ha en isolerende struktur som kalles et skjold. Skjoldet er plassert rundt cellen der varme og temperaturendringer oppstår. På samme måte er den koblet til et elektronisk system som holder temperaturen veldig nær cellens, for å unngå varmeoverføring..
I et adiabatisk kalorimeter er temperaturforskjellen mellom kalorimeteret og dets omgivelser minimert; samt minimere varmeoverføringskoeffisienten og tiden for varmeveksling.
Dens deler består av følgende:
-Cellen (eller beholderen), integrert i et isolasjonssystem ved hjelp av hvilken den prøver å unngå varmetap.
-Termometeret, for å måle temperaturendringer.
-En varmeapparat, koblet til en kontrollerbar kilde til elektrisk spenning.
-Og skjoldet, allerede nevnt.
I denne typen kalorimeter kan egenskaper som entropi, Debye-temperatur og tilstands-elektrontetthet bestemmes..
Isoperibol kalorimeter
Det er en enhet der reaksjonscellen og pumpen er nedsenket i en struktur som kalles en kappe. I dette tilfellet består den såkalte jakken av vann, holdt på en konstant temperatur.
Celle- og pumpetemperaturen stiger når varmen frigjøres under forbrenningsprosessen; men vanntettemperaturen holdes på en fast temperatur.
En mikroprosessor styrer temperaturen på cellen og kappen, og gjør de nødvendige korrigeringene for lekkasjevarmen som skyldes forskjellene mellom de to temperaturene..
Disse korreksjonene blir brukt kontinuerlig, og med en endelig korreksjon, basert på målinger før og etter testen..
Flytkalorimeteret
Utviklet av Caliendar, har den en enhet for å flytte en gass i en container med konstant hastighet. Ved å tilsette varme måles temperaturøkningen i væsken.
Strømningskalorimeteret er preget av:
- En nøyaktig måling av hastigheten til konstant strømning.
- Nøyaktig måling av mengden varme som føres til væsken gjennom en varmeapparat.
- En nøyaktig måling av temperaturøkningen i gassen forårsaket av energiinngang
- Et design for å måle kapasiteten til en gass under trykk.
Kalorimeteret for differensial skanningskalorimetri
Det er preget av å ha to beholdere: i den ene plasseres prøven som skal studeres, mens den andre holdes tom eller det brukes et referansemateriale..
De to karene varmes opp med en konstant energitakt ved hjelp av to uavhengige ovner. Når de to karene begynner å varme seg, vil datamaskinen plotte forskjellen i varmestrøm fra varmeovnene mot temperaturen, slik at varmestrømmen kan bestemmes..
Videre kan variasjonen av temperaturen som en funksjon av tid bestemmes; og til slutt kalorikapasiteten.
applikasjoner
I fysikkjemi
-De grunnleggende kalorimetrene, typen kaffekopp, gjør det mulig å måle mengden varme som kroppen avgir eller absorberer. I dem er det mulig å bestemme om en reaksjon er eksoterm eller endoterm. I tillegg kan kroppens spesifikke varme bestemmes.
-Med det adiabatiske kalorimeteret har det vært mulig å bestemme entropien til en kjemisk prosess og den elektroniske tettheten til staten.
I biologiske systemer
-Mikrokalorimetre brukes til å studere biologiske systemer som inkluderer interaksjoner mellom molekyler, samt de molekylære konformasjonsendringene som oppstår; for eksempel i utfoldelsen av et molekyl. Linjen inkluderer både differensial feiing og isotermisk titrering.
-Mikrokalorimeteret brukes i utviklingen av medisiner med små molekyler, bioterapeutiske midler og vaksiner.
Oksygenpumpekalorimeter og kalorikraft
I oksygenbomberens kalorimeter finner forbrenningen av mange stoffer sted, og dens kaloriverdi kan bestemmes. Blant stoffene som er studert ved bruk av dette kalorimeteret, er: kull og koks; spiselige oljer, både tunge og lette; bensin og alle motorbensiner.
Samt typer drivstoff til flyreaktorer; drivstoffavfall og avfallshåndtering; matvarer og kosttilskudd for menneskelig ernæring; fôrvekster og kosttilskudd for fôr; Bygningsmaterialer; rakettdrivstoff og drivstoff.
Likeledes er kalorieffekten bestemt av kalorimetri i termodynamiske studier av brennbare materialer; i studiet av energibalanse i økologi; i eksplosiver og termiske pulver og i undervisning i grunnleggende termodynamiske metoder.
Referanser
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Læring.
- González J., Cortés L. & Sánchez A. (s.f.). Adiabatisk kalorimetri og dens applikasjoner. Gjenopprettet fra: cenam.mx
- Wikipedia. (2018). Kalorimeter. Gjenopprettet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22. juni 2018). Kalorimeterdefinisjon i kjemi. Gjenopprettet fra: thoughtco.com
- Gillespie, Claire. (11. april 2018). Hvordan fungerer et kalorimeter? Vitenskapelig. Gjenopprettet fra: sciencing.com


Ingen har kommentert denne artikkelen ennå.