
Ammoniumion (NH4 +) formel, egenskaper og bruksområder

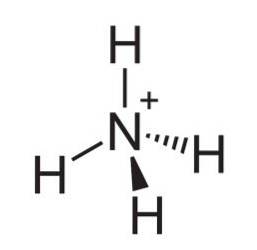
De ammoniumion er en positivt ladet polyatomisk kation hvis kjemiske formel er NH4+. Molekylet er ikke flatt, men er formet som et tetraeder. De fire hydrogenatomene utgjør de fire hjørnene.
Ammoniaknitrogen har et ikke-delt par elektroner som er i stand til å akseptere en proton (Lewis-base), og dermed dannes ammoniumionen ved protonering av ammoniakk i henhold til reaksjonen: NH3 + H+ → NH4+
Navnet ammonium er også gitt til substituerte aminer eller substituerte ammoniumkationer. For eksempel er metylammoniumklorid et ionisk salt med formelen CH3NH4Cl hvor kloridionet er bundet til et metylamin.
Ammoniumionet har egenskaper som ligner på de tyngre alkalimetallene og regnes ofte som en nær slektning. Det forventes at ammonium oppfører seg som et metall ved veldig høyt trykk, for eksempel inne i gassgigantplaneter som Uranus og Neptun..
Ammoniumionet spiller en viktig rolle i proteinsyntese i menneskekroppen. Kort sagt, alle levende ting trenger proteiner, som består av omtrent 20 forskjellige aminosyrer. Mens planter og mikroorganismer kan syntetisere de fleste aminosyrer fra nitrogen i atmosfæren, kan ikke dyr..
For mennesker kan noen aminosyrer ikke syntetiseres i det hele tatt, og de må konsumeres som essensielle aminosyrer.
Andre aminosyrer kan imidlertid syntetiseres av mikroorganismer i mage-tarmkanalen ved hjelp av ammoniakkioner. Dermed er dette molekylet en nøkkelfigur i nitrogensyklusen og i proteinsyntese..
Artikkelindeks
- 1 eiendommer
- 1.1 Løselighet og molekylvekt
- 1.2 Syre-base egenskaper
- 1.3 Ammoniumsalter
- 2 bruksområder
- 3 Referanser
Eiendommer
Løselighet og molekylvekt
Ammoniumionet har en molekylvekt på 18,039 g / mol og en løselighet på 10,2 mg / ml vann (National Center for Biotechnology Information, 2017). Oppløsning av ammoniakk i vann danner ammoniumionet i henhold til reaksjonen:
NH3 + HtoO → NH4+ + Åh-
Dette øker hydroksylkonsentrasjonen i mediet ved å øke pH i løsningen (Royal Society of Chemistry, 2015).
Syrebaseegenskaper
Ammoniumionet har en pKb på 9,25. Dette betyr at ved pH høyere enn denne verdien vil den ha en sur oppførsel og ved lavere pH vil den ha en grunnleggende oppførsel..
For eksempel når det oppløses ammoniakk i eddiksyre (pKa = 4,76), tar det frie elektronparet nitrogen en proton fra mediet, og øker konsentrasjonen av hydroksidioner i henhold til ligningen:
NH3 + CH3COOH ⇌ NH4+ + CH3COO-
Imidlertid, i nærvær av en sterk base, slik som natriumhydroksid (pKa = 14,93), gir ammoniumionen en proton til mediet i henhold til reaksjonen:
NH4+ + NaOH ⇌ NH3 + Na+ + HtoELLER
Avslutningsvis, ved pH mindre enn 9,25, vil nitrogen protoneres, mens det ved pH større enn denne verdien vil bli deprotonert. Dette er av største betydning for å forstå titreringskurver og forstå oppførselen til stoffer som aminosyrer..
Ammoniumsalter
En av de mest karakteristiske egenskapene til ammoniakk er dens kraft til å kombinere direkte med syrer for å danne salter avhengig av reaksjonen:
NH3 + HX → NH4X
Med saltsyre danner den således ammoniumklorid (NH4Cl); Med salpetersyre, ammoniumnitrat (NH4IKKE3), med karbonsyre vil det danne ammoniumkarbonat ((NH4)toCO3) etc.
Det er vist at perfekt tørr ammoniakk ikke vil kombineres med perfekt tørr saltsyre, fuktigheten er nødvendig for å forårsake reaksjonen (VIAS Encyclopedia, 2004).
De fleste enkle ammoniumsalter er veldig oppløselige i vann. Et unntak er ammoniumheksaklorplatinat, hvis dannelse brukes som en test for ammonium. Saltene av ammoniumnitrat og spesielt perklorat er meget eksplosive, i disse tilfellene er ammonium reduksjonsmiddel.
I en uvanlig prosess danner ammoniumionene et amalgam. Slike arter fremstilles ved elektrolyse av en ammoniumoppløsning ved anvendelse av en kvikksølvkatode. Dette amalgamet spaltes til slutt for å frigjøre ammoniakk og hydrogen (Johnston, 2014).
En av de vanligste ammoniumsaltene er ammoniumhydroksid, som ganske enkelt er ammoniakk oppløst i vann. Denne forbindelsen er veldig vanlig og finnes naturlig i miljøet (i luft, vann og jord) og i alle planter og dyr, inkludert mennesker..
applikasjoner
Ammonium er en viktig nitrogenkilde for mange plantearter, spesielt de som vokser i hypoksisk jord. Imidlertid er den også giftig for de fleste avlingsarter og brukes sjelden som den eneste nitrogenkilden (Database, Human Metabolome, 2017).
Nitrogen (N), bundet til proteiner i død biomasse, konsumeres av mikroorganismer og omdannes til ammoniumioner (NH4 +) som kan absorberes direkte av planterøtter (f.eks. Ris).
Ammoniumioner blir vanligvis omdannet til nitrittioner (NO2-) av nitrosomonas-bakterier, etterfulgt av en andre konvertering til nitrat (NO3-) av Nitrobacter-bakterier..
De tre viktigste kildene til nitrogen som brukes i landbruket er urea, ammonium og nitrat. Den biologiske oksidasjonen av ammonium til nitrat er kjent som nitrifisering. Denne prosessen involverer flere trinn og formidles av obligatoriske aerobe, autotrofiske bakterier..
I oversvømmet jord er oksidasjon av NH4 + begrenset. Urea brytes ned av enzymet urease eller kjemisk hydrolyseres til ammoniakk og CO2.
I ammonifiseringstrinnet blir ammoniakk omdannet av ammonifiserende bakterier til ammoniumionen (NH4 +). I neste trinn blir ammonium omdannet av nitrifiserende bakterier til nitrat (nitrifisering).
Denne svært mobile formen for nitrogen absorberes oftest av planterøtter, så vel som mikroorganismer i jorden..
For å lukke nitrogensyklusen blir nitrogengass i atmosfæren omdannet til biomasse nitrogen av Rhizobium-bakterier som lever i rotvevet til belgfrukter (for eksempel alfalfa, erter og bønner) og belgfrukter (som al). Og av cyanobakterier og Azotobacter (Sposito, 2011).
Gjennom ammonium (NH4 +) kan vannplanter absorbere og innlemme nitrogen i proteiner, aminosyrer og andre molekyler. Høye konsentrasjoner av ammoniakk kan øke veksten av alger og vannplanter.
Ammoniumhydroksid og andre ammoniumsalter er mye brukt i matforedling. Food and Drug Administration (FDA) forskrifter sier at ammoniumhydroksid er trygt ("generelt anerkjent som trygt" eller GRAS) som gjærmiddel, pH-kontrollmiddel og etterbehandlingsmiddel. Overfladisk i mat.
Listen over matvarer der ammoniumhydroksid brukes som et direkte tilsetningsstoff er omfattende og inkluderer bakevarer, oster, sjokolade, andre konfektprodukter (f.eks. Godteri) og puddinger. Ammoniumhydroksid brukes også som et antimikrobielt middel i kjøttprodukter.
Ammoniakk i andre former (f.eks. Ammoniumsulfat, ammoniumalginat) brukes i krydder, soyaproteinisolater, snacks, syltetøy og gelé og alkoholfrie drikkevarer (PNA kaliumnitratforening, 2016).
Ammoniummåling brukes i RAMBO-testen, spesielt nyttig ved diagnostisering av årsaken til acidose (Test-ID: RAMBO Ammonium, Random, Urine, S.F.). Nyrene regulerer syreutskillelse og systemisk syre-base balanse.
Å endre mengden ammoniakk i urinen er en viktig måte for nyrene å gjøre dette. Måling av nivået av ammoniakk i urinen kan gi innsikt i årsaken til syre-base balanse forstyrrelse hos pasienter..
Nivået på ammoniakk i urinen kan også gi mye informasjon om den daglige syreproduksjonen hos en gitt pasient. Siden det meste av individets syrebelastning kommer fra inntatt protein, er mengden ammoniakk i urinen en god indikator på inntak av protein..
Målinger av urinammoniakk kan være spesielt nyttige for diagnostisering og behandling av pasienter med nyrestein:
- Høye nivåer av ammoniakk i urinen og lav pH i urinen tyder på pågående gastrointestinale tap. Disse pasientene er i fare for urinsyre og kalsiumoksalatstein..
- Litt ammoniakk i urinen og høy pH i urinen antyder nyre tubulær acidose. Disse pasientene har risiko for kalsiumfosfatstein.
- Pasienter med kalsiumoksalat og kalsiumfosfatstein blir ofte behandlet med sitrat for å øke urinsitratet (en naturlig hemmer av kalsiumoksalat og kalsiumfosfatkrystallvekst)..
Men siden sitrat metaboliseres til bikarbonat (en base), kan dette stoffet også øke pH i urinen. Hvis urinens pH er for høy ved sitratbehandling, kan risikoen for kalsiumfosfatstein økes utilsiktet..
Overvåking av urin for ammoniakk er en måte å titrere sitratdosen og unngå dette problemet. En god startdose av sitrat er omtrent halvparten av ammoniumutskillelsen i urinen (i mEq av hver).
Effekten av denne dosen på urinammonium-, citrat- og pH-verdier kan overvåkes, og citratdosen kan justeres basert på respons. Et fall i ammoniakk i urinen bør indikere om dagens sitrat er tilstrekkelig til å motvirke den daglige syrebelastningen til den gitte pasienten delvis (men ikke helt)..
Referanser
- Database, Human Metabolome. (2017, 2. mars). Viser metakort for Ammonium. Gjenopprettet fra: hmdb.ca.
- Johnston, F. J. (2014). Ammoniumsalt. hentet fra accessscience: accessscience.com.
- Nasjonalt senter for bioteknologisk informasjon. (2017, 25. februar). PubChem Compound Database; CID = 16741146. Hentet fra PubChem.
- PNA kaliumnitratforening. (2016). Nitrat (NO3-) versus ammonium (NH4 +). hentet fra kno3.org.
- Royal Society of Chemistry. (2015). Ammoniumion. Gjenopprettet fra chemspider: chemspider.com.
- Sposito, G. (2011, 2. september). Jord. Gjenopprettet fra leksikon britannica: britannica.com.
- Test-ID: RAMBO ammonium, tilfeldig, urin. (S.F.). Gjenopprettet fra encyclopediamayomedicallaboratorie.com.
- VIAS leksikon. (2004, 22. desember). Ammoniumsalter. Gjenopprettet fra leksikon vias.org.


Ingen har kommentert denne artikkelen ennå.