
Kaliumkarbonat (K2CO3) struktur, egenskaper, bruksområder, produksjon

De Kaliumkarbonat er en uorganisk forbindelse dannet av to kalium K-ioner+ og et karbonation CO3to-. Dens kjemiske formel er KtoCO3. Det er et hygroskopisk hvitt fast stoff, det vil si at det lett absorberer vann fra miljøet. Av denne grunn brukes det i laboratorier til å absorbere vann fra andre stoffer..
Det er veldig løselig i vann og danner alkaliske løsninger som er rike på OH-ioner.-og derfor med høy pH-verdi. Dens vandige løsninger, som er basiske, brukes i forskjellige industrielle prosesser for å absorbere sure gasser som karbondioksid COto og hydrogensulfid HtoJa, det nøytraliserer dem lett.

KtoCO3 Den brukes til å tilberede såper, rengjøringsprodukter, vaskemidler og oppvaskmiks. Den brukes også til behandling av noen tekstilfibre som ull..
Det er mye brukt i kjemilaboratorier, for eksempel for å absorbere vann fra andre forbindelser eller for å alkalisere blandinger av kjemiske reaksjoner og også i kjemisk analyse.
Det er også lagt til noen matvarer, for eksempel for å eliminere den bitre smaken av kakaobønner under produksjonen av sjokolade..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3,5 Tetthet
- 3.6 Løselighet
- 3,7 pH
- 3.8 Kjemiske egenskaper
- 4 Motta
- 5 bruksområder
- 5.1 I absorpsjon av CO2 i industrielle prosesser
- 5.2 Ved fjerning av H2S fra visse prosesser
- 5.3 I kjemilaboratorier
- 5.4 I rengjøringsmiddelindustrien
- 5.5 I næringsmiddelindustrien
- 5.6 I gjødsel
- 5.7 I forskjellige applikasjoner
- 6 Referanser
Struktur
Kaliumkarbonat består av to kalium K-kationer+ og et karbonatanion CO3to-. Karbonatanionen har en flat og symmetrisk struktur, mens de tre oksygenatomene omgir karbonet og danner en flat trekant..
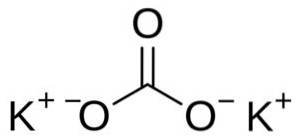
Nomenklatur
- Kaliumkarbonat
- Kaliumkarbonat
- Kaliumkarbonat
- Potash
- Kaliumsalt av karbonsyre.
Eiendommer
Fysisk tilstand
Fargeløst til hvitt krystallinsk fast stoff.
Molekylær vekt
138,205 g / mol.
Smeltepunkt
899 ºC.
Kokepunkt
Det nedbrytes.
Tetthet
2,29 g / cm3
Løselighet
Svært løselig i vann: 111 g / 100 g vann ved 25 ° C. Uoppløselig i etanol og aceton.
pH
En vandig løsning kan ha en pH på 11,6, det vil si at den er ganske alkalisk.
Kjemiske egenskaper
Kaliumkarbonat er lekker eller hygroskopisk, det vil si at det absorberer fuktighet fra miljøet. Den har et stabilt hydrat, KtoCO3.2HtoELLER.
KtoCO3 i vandig løsning hydrolyserer den, det vil si at den reagerer med vann som frigjør OH-grupper- som er de som gir løsningene alkalitet:
CO3to- + HtoO ⇔ OH- + HCO3-
HCO3- + HtoO ⇔ OH- + HtoCO3
Å skaffe
Det kan fås fra asken som er igjen når du brenner planter. Også ved karbonatisering av kaliumhydroksyd KOH, det vil si tilsetning av overflødig karbondioksid COto til KOH:
KOH + COto → KHCO3
2 KHCO3 + varme → KtoCO3 + HtoELLER
En annen måte å oppnå det på er å oppvarme kaliumklorid KCl med magnesiumkarbonat MgCO3, vann og COto under press. Et hydratisert dobbelt salt av magnesium og kalium oppnås først MgCO3.KHCO3.4HtoEller, kalt Engels salt:
2 KCl + 3 MgCO3 + COto + 5 timertoO → MgCO3.KHCO3.4HtoO ↓ + MgClto
Engels 'hydratiserte dobbeltsalt utfelles og filtreres ut av løsningen. Deretter varmes det opp og kaliumkarbonatet K dannestoCO3 at når du tilsetter vann oppløses mens magnesiumkarbonat MgCO3 forblir uoppløselig og fjernes ved filtrering.
MgCO3.KHCO3.4HtoO + varme → MgCO3↓ + 2K+ + CO3to- + COto↑ + 9 HtoELLER
applikasjoner
I absorpsjonen av COto i industrielle prosesser
Kaliumkarbonatløsningen er den klassiske behandlingen for fjerning av karbondioksid COto i forskjellige prosesser, spesielt i applikasjoner med høyt trykk og høy temperatur.

Fjerning av COto forekommer i henhold til følgende reaksjon:
KtoCO3 + COto + HtoO ⇔ 2 KHCO3
Denne metoden brukes for eksempel til å behandle naturgass. Også i kraftproduksjon for å unngå utslipp av COto inn i atmosfæren, og i produksjonen av tørris.

Ks løsningtoCO3 kan regenereres termisk, det vil si ved oppvarming til temperaturer rundt 100 ° C.
For at kaliumkarbonatløsningen kan absorbere CO2 med god hastighet, tilsettes promotere som fremskynder prosessen som dietanolamin (DEA)..
Ved fjerning av HtoS av visse prosesser
Kaliumkarbonatløsninger brukes også til å fjerne hydrogensulfidgass HtoS for prosessstrømmer. Kalium K-trifosfat tilsettes noen ganger3PO4 for å gjøre prosessen raskere.
I kjemilaboratorier
KtoCO3 Det gjør det mulig å utføre organiske synteser, for eksempel i kondensreaksjoner og å nøytralisere. Den brukes til å fjerne vann fra organiske væsker, som et dehydratiseringsmiddel eller tørkemiddel i laboratoriet.
Det brukes også i analytiske kjemiske reaksjoner og til alkalisering i farmasøytisk industri..
I rengjøringsmiddelindustrien
KtoCO3 Den brukes til å lage såpe, rengjøringsformler, klesvask og oppvaskprodukter, og også til å forberede sjampo og andre produkter for personlig pleie.

I næringsmiddelindustrien
Kaliumkarbonat tilsettes forskjellige matvarer til forskjellige formål.
For eksempel blir det tilsatt kakaobønner for å fjerne den bitre smaken og bruke dem til produksjon av sjokolade. Det tilsettes druene i tørkeprosessen for å få rosiner.

I bakverk brukes det som et hevemiddel (som fungerer som gjær) for mel for å tilberede bakevarer..

I gjødsel
KtoCO3 Den brukes til å gjødsle sure jordarter, siden karbonationen CO3to- i kontakt med vann produserer OH-ioner- som øker jordens pH. Pluss kalium K+ det er et næringsstoff for planter.
Kaliumkarbonat har også blitt brukt til å lage gjødsel med langsom frigjøring.
En gjødsel med langsom frigjøring frigjør eller frigjør næringsstoffer sakte slik at de ikke oppløses og vaskes bort. Takket være dette vil de kunne bruke mer tid tilgjengelig til plantens røtter.
I forskjellige applikasjoner
Kaliumkarbonat KtoCO3 det brukes også til å:
- Rå ullfarging, bleking og rengjøringsprosesser og andre aktiviteter i tekstilindustrien
- Å skaffe andre organiske og uorganiske kaliumsalter, slik som KCN kaliumcyanid.
- Fungere som en surhetsregulator i forskjellige prosesser.
- Lager keramikk og keramikk.
- Graverings- og litografiprosesser.
- Garvning og etterbehandling av lær.
- Forbered blekk for utskrift, pigmenter.
- Produserer briller spesielt for TV, siden KtoCO3 er mer kompatibel enn natriumkarbonat NatoCO3 med bly, barium og strontiumoksider inneholdt i disse glassene.
- Vannbehandling.
- Brannhemmende (i form av vandige løsninger).
- Hemme korrosjon og som et bunnstoff i prosessutstyr.
Referanser
- OSS. National Library of Medicine. (2019). Kaliumkarbonat. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Steele, D. (1966). Metalliske elementers kjemi. Pergamon Press Ltd. London.
- Mokhatab, S. et al. (2019). Naturlig gassbehandling. Kaliumkarbonatløsningen. I håndbok for overføring og prosessering av naturgass (fjerde utgave). Gjenopprettet fra sciencedirect.com.
- Kakaras, E. et al. (2012). PFBC-kombinert syklusanlegg med fluidisert seng. Forbrenning med fluidisert seng under trykk med karbonfangst og lagring. I kombinerte syklusanlegg for kraftgenerering med nesten null utslipp. Gjenopprettet fra sciencedirect.com.
- Speight, J.G. (2019). Hydrogenproduksjon. Våt skrubbing. I utvinning og oppgradering av tungolje. Gjenopprettet fra sciencedirect.com.
- Branan, C.R. (2005). Bensinbehandling: Kapittel oppdatert av Chris Higman. Varme karbonatprosesser. In Rules of Thumb for Chemical Engineers (fjerde utgave). Gjenopprettet fra sciencedirect.com.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte utgave. VCH Verlagsgesellschaft mbH.
- Li, Y. og Cheng, F. (2016). Syntese av en ny kaliumgjødsel med langsom frigjøring fra modifisert Pidgeon magnesiumslagg av kaliumkarbonat. J Air Waste Manag Assoc, 2016 aug; 66 (8): 758-67. Gjenopprettet fra ncbi.nlm.nih.gov.



Ingen har kommentert denne artikkelen ennå.