
Carnot syklus stadier, applikasjoner, eksempler, øvelser
De Carnot syklus det er sekvensen av termodynamiske prosesser som finner sted i en Carnot-motor, en ideell enhet som bare består av reversible typeprosesser; det vil si de som har funnet sted, kan gå tilbake til opprinnelig tilstand.
Denne typen motor anses som ideell, siden den mangler spredning, friksjon eller viskositet som oppstår i virkelige maskiner, og omdanner termisk energi til brukbart arbeid, selv om konverteringen ikke utføres 100%.

En motor er bygget med utgangspunkt i et stoff som er i stand til å utføre arbeid, for eksempel gass, bensin eller damp. Dette stoffet blir utsatt for forskjellige temperaturendringer og opplever i sin tur variasjoner i trykk og volum. På denne måten er det mulig å flytte et stempel inne i en sylinder.
Artikkelindeks
- 1 Hva er carnot-syklusen?
- 2 trinn i Carnot-syklusen
- 2.1 Utgangspunkt
- 2.2 Første trinn: isoterm ekspansjon
- 2.3 Andre trinn: adiabatisk utvidelse
- 2.4 Tredje trinn: isoterm kompresjon
- 2.5 Fjerde trinn: adiabatisk kompresjon
- 3 Carnots teorem
- 3.1 Bevis på Carnots teorem
- 3.2 Resultat av teorem og begrensninger
- 4 Eksempler
- 4.1 Et stempel inne i en sylinder
- 4.2 Ulike reversible prosesser
- 4.3 Et atomkraftverk
- 5 Øvelser løst
- 5.1-Eksempel 1: effektivitet til en varmemotor
- 5.2-Eksempel 2: absorbert varme og varmeoverført
- 6 Referanser
Hva er carnot-syklusen?
Carnot-syklusen foregår i et system kalt Carnot-motoren eller C, som er en ideell gass innesluttet i en sylinder og utstyrt med et stempel som er i kontakt med to kilder ved forskjellige temperaturer T1 og Tto som den som er vist i figuren nedenfor til venstre.
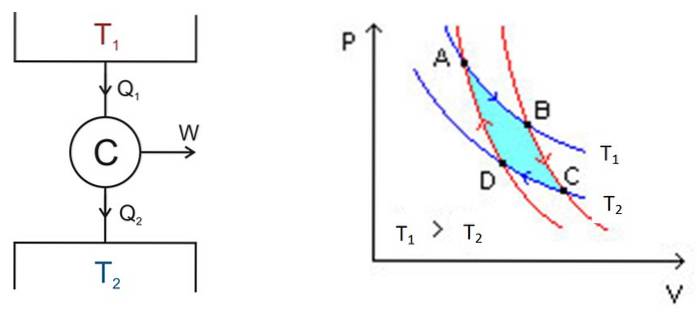
Der foregår følgende grove prosesser:
- En viss mengde varme tilføres enheten Qinngang = Q1 fra termotanken ved høy temperatur T1.
- Carnots motor C utfører arbeid W takket være denne tilførte varmen.
- En del av varmen som brukes: avfallet Qexit, overføres til den termiske tanken som har en lavere temperatur Tto.
Stadier av Carnot-syklusen
Analysen utføres ved hjelp av et PV-diagram (Pressure -Volume), som vist i figur 2 (høyre figur). Hensikten med motoren kan være å holde det termiske reservoaret 2 kjølig og trekke ut varme fra det. I dette tilfellet er det en kjøling maskin. Hvis du derimot vil overføre varme til termisk tank 1, er det en varmepumpe.
P-V-diagrammet viser endringene i motorens trykk - temperatur under to forhold:
- Holde temperaturen konstant (isotermisk prosess).
- Ingen varmeoverføring (varmeisolasjon).
De to isotermiske prosessene må kobles sammen, noe som oppnås ved termisk isolasjon.
Punkt
Du kan starte når som helst i syklusen, der gassen har visse forhold for trykk, volum og temperatur. Gassen gjennomgår en rekke prosesser og kan gå tilbake til startforholdene for å starte en ny syklus, og den endelige interne energien er alltid den samme som den første. Siden energi er bevart:
Arbeid utført av C = Heat input - Heat output
ΔW = Qinngang - Spørsmålexit
Området i denne sløyfen eller sløyfen, i turkis på figuren, tilsvarer nøyaktig arbeidet med Carnot-motoren.
I figur 2 er punkt A, B, C og D. Vi markerer punkt A etter den blå pilen..
Første trinn: isoterm ekspansjon
Temperaturen mellom punktene A og B er T1. Systemet absorberer varme fra det termiske reservoaret 1 og gjennomgår en isoterm ekspansjon. Da øker volumet og trykket avtar.
Imidlertid forblir temperaturen på T1, siden når gassen utvides, avkjøles den. Derfor forblir den indre energien konstant.
Andre trinn: adiabatisk utvidelse
På punkt B begynner systemet en ny utvidelse der systemet verken får eller mister varme. Dette oppnås ved å plassere den i varmeisolasjon som angitt ovenfor. Derfor er det en adiabatisk utvidelse som fortsetter å peke C etter den røde pilen. Volumet øker og trykket synker til den laveste verdien.
Tredje trinn: isoterm kompresjon
Den begynner ved punkt C og slutter ved D. Isolasjonen fjernes og systemet kommer i kontakt med termisk tank 2, hvis temperatur Tto er mindre. Systemet overfører spillvarme til det termiske reservoaret, trykket begynner å øke og volumet å synke.
Fjerde trinn: adiabatisk kompresjon
Ved punkt D går systemet tilbake til varmeisolasjon, trykket øker og volumet synker til det når de opprinnelige forholdene i punkt A. Deretter gjentas syklusen igjen..
Carnots teorem
Carnots teorem ble først postulert tidlig på 1800-tallet av den franske fysikeren Sadi Carnot. I 1824 utgav Carnot, som var en del av den franske hæren, en bok der han foreslo svaret på følgende spørsmål: under hvilke forhold har en varmemotor maksimal effektivitet? Carnot etablerte deretter følgende:
Ingen varmemotor som går mellom to varmemagasiner er mer effektiv enn Carnot-motoren.
Effektiviteten η til en varmemotor er gitt av kvotienten mellom arbeidet W og den absorberte varmen Q:
ytelse = utført arbeid / varme absorbert
På denne måten er effektiviteten til enhver varmemotor I: η = W / Q. Mens effektiviteten til en Carnot-motor R er η '= W / Q', forutsatt at begge motorene er i stand til å gjøre det samme arbeidet.
Carnots teorem sier at η aldri er større enn η '. Ellers faller det i strid med termodynamikkens andre lov, ifølge hvilken en prosess der resultatet er at varme kommer ut av en kropp med lavere temperatur for å gå til en høyere temperatur uten å motta ekstern hjelp er umulig. Derfor:
η < η'
Bevis på Carnots teorem
For å vise at dette er slik, bør du vurdere Carnot-motoren som fungerer som en kjølemaskin som drives av en I. Dette er mulig siden Carnot-motoren fungerer ved reversible prosesser, som spesifisert i begynnelsen..
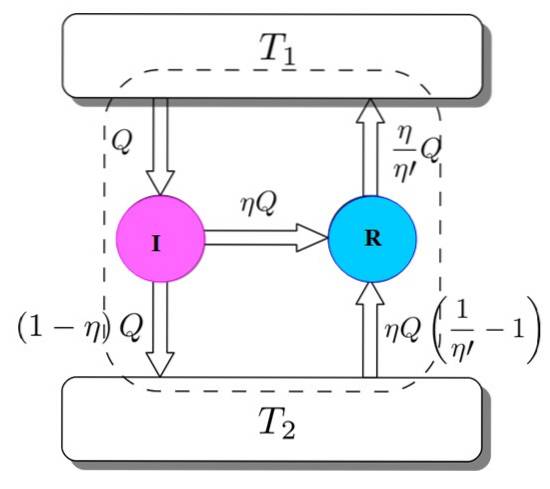
Vi har begge: I og R arbeider med de samme termiske reservoarene, og det antas at η > η'. Hvis det underveis oppnås en motsetning med termodynamikkens andre lov, bevises Carnos teorem ved reduksjon til absurditet.
Figur 3 hjelper deg med å følge prosessen. Motoren I tar inn en mengde varme Q, som den deler på denne måten: gjør arbeid på R tilsvarende W = ηQ, og resten er varmen som overføres (1-η) Q til det termiske reservoaret Tto.
Siden energi er bevart, er alt av følgende sant:
OGinngang = Q = Arbeid W + varme gitt til Tto = ηQ + (1-η) Q = Eexit
Nå tar Carnot kjølemaskin R fra varmebeholderen 2 en mengde varme gitt av:
(η / η ') (1-η') Q =
Energi må også spares i dette tilfellet:
OGinngang = ηQ + (η / η ') (1-η') Q = (η / η ') Q = Q' = Eexit
Resultatet er overføringen til termotanken Tto av en mengde varme gitt av (η / η ') Q = Q'.
Hvis η er større enn η ', betyr det at mer varme har nådd termisk avleiring av høyere temperatur enn jeg opprinnelig tok. Siden ingen eksterne stoffer, som en annen varmekilde, har deltatt, er den eneste måten å skje på at det kaldeste termiske reservoaret gir opp varmen..
Dette er uenig med termodynamikkens andre lov. Det ble da konkludert med at det ikke er mulig at η' er mindre enn η, derfor kan motoren I ikke ha mer effektivitet enn Carnot-maskinen R.
Resultat av teorem og begrensninger
Resultatet av Carnots teorem sier at to Carnot-maskiner har samme effektivitet hvis de begge opererer med de samme termiske reservoarene..
Det betyr at uansett stoff, ytelsen er uavhengig og kan ikke løftes ved å endre den..
Konklusjonen fra analysen ovenfor er at Carnot-syklusen er den ideelt oppnåelige toppen av den termodynamiske prosessen. I praksis er det mange faktorer som reduserer effektiviteten, for eksempel det faktum at isolasjonen aldri er perfekt, og i adiabatiske stadier er det faktisk varmeutveksling med utsiden.
I tilfelle en bil blir motorblokken varm. På den annen side oppfører blandingen av bensin og luft seg ikke akkurat som en ideell gass, som er utgangspunktet for Carnot-syklusen. Dette for å nevne noen få faktorer som vil føre til en drastisk reduksjon i ytelsen.
Eksempler
Et stempel inne i en sylinder
Hvis systemet er et stempel innesluttet i en sylinder som i figur 4, stiger stempelet under isotermisk ekspansjon, som man kan se i det første diagrammet ytterst til venstre, og stiger også under adiabatisk ekspansjon.
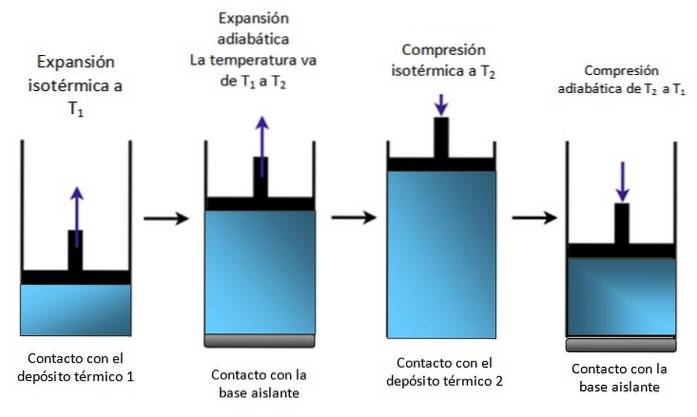
Den komprimeres deretter isotermisk, gir opp varmen og fortsetter å komprimere adiabatisk. Resultatet er en bevegelse der stemplet går opp og ned inne i sylinderen og som kan overføres til andre deler av en bestemt enhet, for eksempel en bilmotor som produserer dreiemoment eller en dampmotor.
Ulike reversible prosesser
I tillegg til utvidelse og kompresjon av en ideell gass inne i en sylinder, er det andre ideelle reversible prosesser som en Carnot-syklus kan konfigureres med, for eksempel:
- Frem og tilbake bevegelser i fravær av friksjon.
- En ideell fjær som komprimerer og dekomprimerer og aldri deformeres.
- Elektriske kretser der det ikke er motstander for å spre energi.
- Magnetiserings- og demagnetiseringssykluser der det ikke er tap.
- Lade og tømme et batteri.
Et atomkraftverk
Selv om det er et veldig komplekst system, er en første tilnærming av det som kreves for å produsere energi i en atomreaktor som følger:
- En termisk kilde, bestående av et radioaktivt råtnende materiale som uran.
- Den kalde varmeavlederen eller reservoaret som ville være atmosfæren.
- "Carnot-motoren" som bruker væske, nesten alltid vann fra springen, som det tilføres varme fra den termiske kilden for å konvertere den til damp.
Når syklusen utføres, oppnås elektrisk energi som nettoarbeid. Når det blir transformert til damp ved høy temperatur, får vannet til å nå en turbin, der energien blir transformert til bevegelse eller kinetisk energi.
Turbinen driver i sin tur en elektrisk generator som forvandler energien til bevegelsen til elektrisk energi. I tillegg til spaltbart materiale som uran, kan selvfølgelig fossile brensler brukes som varmekilde..
Løst øvelser
-Eksempel 1: effektivitet til en varmemotor
Effektiviteten til en varmemotor er definert som kvotienten mellom utgangsarbeidet og inngangsarbeidet, og det er derfor en dimensjonsløs mengde:
Maksimal effektivitet = (Qinngang - Spørsmål exit) / Qinngang
Betegner maksimal effektivitet som emaks, det er mulig å demonstrere sin avhengighet av temperatur, som er den enkleste variabelen å måle, for eksempel:
ogmaks = 1 - (Tto/ T1)
Hvor Tto er sumptemperaturen og T1 er temperaturen på varmekilden. Siden sistnevnte er større, viser effektiviteten seg alltid å være mindre enn 1.
Anta at du har en varmemotor som kan fungere på følgende måter: a) Mellom 200 K og 400 K, b) Mellom 600 K og 400 K. Hva er effektiviteten i hvert tilfelle?
Løsning
a) I det første tilfellet er effektiviteten:
ogmaks1 = 1 - (200/400) = 0,50
b) For den andre modusen vil effektiviteten være:
ogmaks2 = 1- (400/600) = 0,33
Selv om temperaturforskjellen er den samme mellom begge modusene, er effektiviteten ikke. Og enda mer bemerkelsesverdig er at den mest effektive modusen fungerer ved en lavere temperatur..
-Eksempel 2: absorbert varme og frigitt varme
En 22% effektiv varmemotor produserer 1.530 J arbeid. Finn: a) Mengden varme som absorberes fra termisk tank 1, b) Mengden varme som slippes ut til termisk tank 2.
a) I dette tilfellet brukes definisjonen av effektivitet, siden arbeidet som er utført er tilgjengelig, ikke temperaturene til termotankene. En effektivitet på 22% betyr at e maks = 0,22, derfor:
Maksimal effektivitet = Arbeid / Qinngang
Mengden absorbert varme er nøyaktig Spørsmålinngang, så klarering har vi:
Spørsmålinngang = Arbeid / effektivitet = 1530 J / 0,22 = 6954,5 J
b) Mengden varme som overføres til den kaldeste tanken, blir funnet fra ΔW = Qinngang - Spørsmålexit
Spørsmålexit = Qinngang - ΔW = 6954,5 -1530 J = 5424,5 J.
En annen måte er fra ogmaks = 1 - (Tto/ T1). Siden temperaturene ikke er kjent, men de er relatert til varme, kan effektiviteten også uttrykkes som:
ogmaks = 1 - (Qga etter/ Qabsorbert)
Referanser
- Bauer, W. 2011. Fysikk for ingeniørfag og vitenskap. Volum 1. Mc Graw Hill. 654-657
- Kjernekraft. Drift av et atomkraftverk. Gjenopprettet fra: energia-nuclear.net
- Serway, R., Jewett, J. (2008). Fysikk for naturvitenskap og ingeniørfag. Volum 1. 7. Ed. Cengage Learning. 618-622.
- Tippens, P. 2011. Fysikk: Konsepter og applikasjoner. 7. utgave. MacGraw Hill. 414-416.
- Walker, J. 2008. Fysikk. 4. utgave Addison Wesley. 610-630


Ingen har kommentert denne artikkelen ennå.