
Bromsyre (HBrO3) egenskaper, risikoer og bruksområder
De bromsyre, Også kjent som hydrogenbromat eller bromsyre (V), det er en kjemisk forbindelse med formelen HBrO3. Det er en bromsoksid med en struktur som er analog med klorsyre (EMBL-EBI, 2014). Forbindelsen er en veldig sterk syre. Dens struktur er presentert i figur 1 (EMBL-EBI, 2008).
For å fremstille bromsyre oppløses vanligvis et løselig bromat i vann og det tilsettes et løselig bariumsalt. Lavoppløselig bariumbromat utfeller.
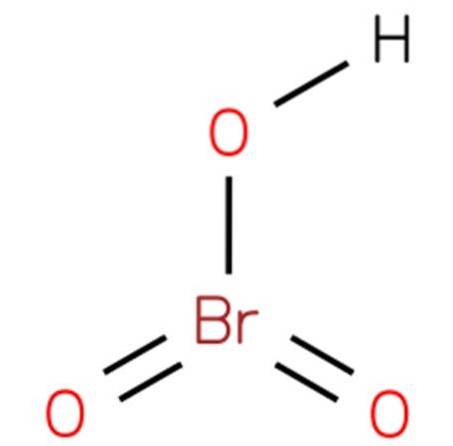
Bariumbromatet kan deretter oppløses i vann og surgjøres med svovelsyre for å utfelle det i utgangspunktet uoppløselige bariumsulfatet og la bromsyren ligge igjen (se bildet ovenfor):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO3) 2 (aq) + H2SO4 (aq) -> 2HBrO3 + BaSO4
Forbindelsen kan også fremstilles ved spaltning av brompentaklorid i alkalisk løsning i henhold til reaksjonen:
BrCl5 + 3 H2O → HBrO3 + 5 HC1
Bromsyre er et sterkt oksidasjonsmiddel. Bromationet kan ytterligere oksyderes med elementært fluor eller xenondifluorid i nærvær av base, oksidasjon ledsaget av små eksplosjoner og Teflon-røret er i brann (My Favorite Chemicals, S.F.).
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper til bromsyre
- 2 Reaktivitet og farer
- 2.1 I tilfelle kontakt med øynene
- 2.2 Ved hudkontakt
- 2.3 Ved innånding
- 3 bruksområder
- 4 Referanser
Fysiske og kjemiske egenskaper til bromsyre
Bromsyre eksisterer bare i fargeløs løsning (opptil 50% vekt / volum) som blir gulaktig i kontakt med luft (National Center for Biotechnology Information., 2017). Utseendet er vist i figur 2.

Forbindelsen har en molekylvekt på 128,91 g / mol og spaltes ved 100 ° C og har en pKa på -2. Å være en ustabil forbindelse, ble dens fysisk-kjemiske egenskaper oppnådd gjennom beregningsberegninger..
Den har et smeltepunkt på 206,04 ° C, et kokepunkt på 517,26 ° C og en oppløselighet i vann på 1 x 106 mg / l ved 25 ° C (Royal Society of Chemistry, 2015).
Forbindelsen er et sterkt oksidasjonsmiddel. Når det blandes med etanol eller eter, spaltes det for å danne eddiksyre i en eksoterm reaksjon. Det er viktig for utarbeidelsen av bromatsalter (BrO3-) som fremstilles ved å reagere karbonater eller metalloksider med bromsyre (Watts, 1870).
Reaktivitet og farer
Bromsyre er en ustabil forbindelse som brytes ned til elementært brom. Å være en sterk syre, er det ekstremt farlig i tilfelle hudkontakt (etsende og irriterende), i kontakt med øynene (irriterende) og i tilfelle svelging. Veldig farlig også ved innånding.
Alvorlig overeksponering kan forårsake lungeskade, kvelning, bevissthetstap eller død. Langvarig eksponering kan forårsake forbrenning og sår i huden. Overeksponering ved innånding kan forårsake irritasjon av luftveiene..
Betennelse i øyet er preget av rødhet, vanning og kløe. Betennelse i huden er preget av kløe, peeling, rødhet og av og til blemmer.
Stoffet er giftig for nyrer, lunger og slimhinner. Gjentatt eller langvarig eksponering for stoffet kan forårsake skade på disse organene..
Ved kontakt med øynene
Sjekk om det brukes kontaktlinser og fjern dem umiddelbart. Øynene skal spyles med rennende vann i minst 15 minutter, og hold øyelokkene åpne. Kaldt vann kan brukes. Øyesalve skal ikke brukes.
Ved hudkontakt
Hvis kjemikaliet kommer i kontakt med klær, må du fjerne det så raskt som mulig, og beskytte dine egne hender og kropp. Sett offeret under en sikkerhetsdusj.
Hvis kjemikaliet akkumuleres på utsatt hud fra offeret, for eksempel hender, vaskes den forurensede huden forsiktig og forsiktig med rennende vann og ikke-slipende såpe. Kaldt vann kan brukes. Hvis irritasjon vedvarer, kontakt lege. Vask de forurensede klærne før du bruker dem igjen.
Hvis hudkontakten er alvorlig, bør den vaskes med et desinfiserende såpe og dekke forurenset hud med en antibakteriell krem..
Ved innånding
Det anbefales å la offeret hvile i et godt ventilert område. Hvis innånding er alvorlig, skal offeret evakueres til et trygt område så snart som mulig. Løsne stramme klær som en skjortekrage, belte eller slips. Hvis offeret har vanskelig for å puste, bør oksygen administreres.
Hvis offeret ikke puster, utføres gjenoppliving fra munn til munn. Husk alltid at det kan være farlig for personen som yter hjelp til å gi gjenoppliving fra munn til munn når det inhalerte materialet er giftig, smittsom eller etsende..
Ved svelging, fremkall ikke brekninger. Løsne tette klær som skjortekrage, belter eller slips. Hvis offeret ikke puster, må du utføre gjenoppliving fra munn til munn.
I alle tilfeller, søk øyeblikkelig legehjelp..
applikasjoner
Bromsyre brukes som et kraftig oksidasjonsmiddel i laboratoriereaksjoner. Den brukes til å produsere kjemiske forbindelser som jodater, klorsyre, tetraihonsyre blant andre..
Det brukes også til produksjon av bromater som jern, bly, mangan og kvikksølvbromat..
Bromsyre fungerer som et viktig mellomprodukt i Bélousov-Zhabotinsky-reaksjonen (Morris, 2010). Denne reaksjonen er et eksempel på kjemiske klokker og illustrerer en termodynamisk ikke-likevektsreaksjon.
Oscillasjonsreaksjonen katalyseres av cerium og er iboende forbundet med kjemien til bromoksosyrer HBrOx. Den økende interessen for ikke-lineære kjemiske systemer har gitt sterke insentiver til å studere kjemi av brom..
I Belousov-Zhabotinsky-reaksjonen er de involverte bromforbindelsene hypobromsyre HOBr, bromsyre HOBrO og bromsyre HBrO3 (3) (Rainer Glaser, 2013).
Disse typer reaksjoner er viktige for teoretisk kjemi. De viser at kjemiske reaksjoner ikke trenger å bli dominert av likevektstermodynamisk oppførsel.
Referanser
- Bromsyre. (S.F.). Gjenopprettet fra chemyq.com.
- EMBL-EBI. (2008, 16. mai). bromsyre. Gjenopprettet fra ebi.ac.uk.
- EMBL-EBI. (2014, 28. juli). klorsyre. Gjenopprettet fra ebi.ac.uk.
- Morris, S. (2010, 23. januar). Belousov Zhabotinsky-reaksjon 8 x normal hastighet. Gjenopprettet fra youtubecom.
- Mine favorittkjemikalier. (S.F.). Gjenopprettet fra bromicacid.com.
- Nasjonalt senter for bioteknologisk informasjon. (2017, 11. mars). PubChem Compound Database; CID = 24445 ,. Hentet fra PubChem.
- Rainer Glaser, M. D. (2013). Hvorfor surheten av bromsyre virkelig betyr noe for kinetiske modeller av Belousov-Zhabotinsky oscillerende kjemiske reaksjoner. Journal of Thermodynamics & Catalysis 4: 1.
- Royal Society of Chemistry. (2015). Bromsyre. Gjenopprettet fra chemspider.com.
- Watts, H. (1870). A Dictionary of Chemistry and Allied Branches of Other Sciences, bind 1. London: longmans, green and co.


Ingen har kommentert denne artikkelen ennå.