
Sulfonsyrestruktur, nomenklatur, egenskaper, bruksområder

Det kalles sulfonsyre hvilken som helst forbindelse som tilhører en familie av organiske syrer som har en eller flere -SO-grupper3H. Enkelte forfattere indikerer at stamforbindelsen er HS (= O)to-OH, eller H-SO3H, kalt av noen "sulfonsyre", men dens eksistens er imidlertid ikke bevist, heller ikke den for dens tautomer HO-S (= O) -OH kjent som "svovelsyre" (HtoSW3), verken i oppløsning eller i fast tilstand.
Sistnevnte skyldes at svoveldioksydgass (IV) (SOto) i vandig oppløsning omdannes til bisulfittioner (HSO3-) og pyrosulfitt (StoELLER5to-) og ikke HS (= O)to-OH eller til HO-S (= O) -OH, som allerede er bekreftet av mange kjemiske forskere.
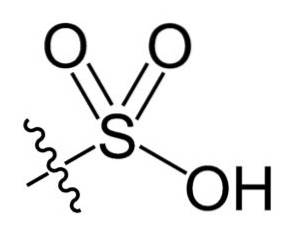
I den kjemiske formelen R-SO3H av sulfonsyrer kan gruppen R representere hydrokarbonskjeletter så som alkan, alken, alkyn og / eller arene. Disse kan inneholde sekundære funksjonaliteter som ester-, eter-, keton-, amino-, amido-, hydroksyl-, karboksyl- og fenolgrupper, blant mange andre..
Sulfonsyrer er sterke syrer, sammenlignbare med svovelsyre (HtoSW4). Resten av eiendommene avhenger imidlertid i stor grad av R-gruppens natur..
Noen har en tendens til å desulfonere ved høye temperaturer. Dette betyr å miste -SO-gruppen3H, spesielt når R er en arene, det vil si med en benzenring.
Sulfonsyrer har mange bruksområder, avhengig av deres kjemiske formel. De brukes til å lage fargestoffer, blekk, polymerer, vaskemidler, overflateaktive stoffer og som katalysatorer, blant mange andre bruksområder..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 4 Motta
- 4.1 Arylsulfonsyrer
- 4.2 Alkylsulfonsyrer
- 5 bruksområder
- 5.1 Sulfonsyrer for overflateaktive stoffer og vaskemidler
- 5.2 Fargestoffer basert på sulfonsyrer
- 5.3 Amider basert på sulfonsyrer
- 5.4 Fluorerte og klorfluorerte sulfonsyrer
- 5.5 I biologiske anvendelser
- 5.6 I oljeindustrien
- 5.7 I formuleringen av smøremidler og antikorrosjonsmidler
- 6 Referanser
Struktur
Sulfonsyrer har følgende generelle struktur:
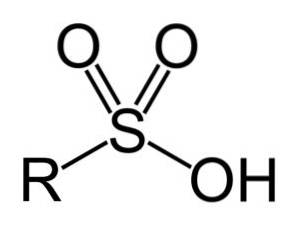
Nomenklatur
- Sulfonylgruppe: -SO3H
- Alkyl- eller arylsulfonsyre: R-SO3H
Eiendommer
De er faste eller flytende avhengig av gruppen R. Gassformige sulfonsyrer er ikke kjent.
Deres fysiske og kjemiske egenskaper avhenger av naturen til R-gruppen. Til sammenligning presenteres noen fysiske egenskaper for forskjellige sulfonsyrer, hvor smp. er smeltepunktet og f.eks. er kokepunktet ved et trykk på 1 mm Hg:
- Metansulfonsyre: smp. 20 ° C; f.eks. 122 ºC
- Etansulfonsyre: smp. -17 ° C; f.eks. 123 ºC
- Propanesulfonsyre: smp. -37 ° C; f.eks. 159 ºC
- Butansulfonsyre: smp. -15 ° C; f.eks. 149 ºC
- Pentansulfonsyre: smp. -16 ° C; f.eks. 163 ºC
- Heksansulfonsyre: smp. 16 ° C; f.eks. 174 ºC
- Benzensulfonsyre: smp. 44 ° C; f.eks. 172 ºC (ved 0,1 mm Hg)
- P-toluensulfonsyre: smp. 106 ° C; f.eks. 182 ºC (ved 0,1 mm Hg)
- 1-naftalensulfonsyre: smp. 78 ° C; f.eks. Det nedbrytes
- 2-naftalensulfonsyre: smp. 91 ° C; f.eks. Det nedbrytes
- Trifluormetansulfonsyre: smp. ingen; f.eks. 162 ºC (ved 760 mm Hg)
De fleste er veldig oppløselige i vann.
Sulfonsyrer er enda surere enn karboksylsyrer. De har surhet som svovelsyre. Oppløs i vandig natriumhydroksyd og vandig bikarbonat.
De har en tendens til å gjennomgå termisk nedbrytning, forårsaker avsvovling. Imidlertid er flere av alkansulfonsyrene termisk stabile. Spesielt er triflysyre, eller trifluormetansulfonsyre, en av de sterkeste og mest stabile syrene.
Å skaffe
Arylsulfonsyrer
Arylsulfonsyrer oppnås vanligvis ved sulfoneringsprosessen som består i å tilsette et overskudd av gassende svovelsyre (HtoSW4 + SW3) til den organiske forbindelsen som vi ønsker å sulfonere. For eksempel når det gjelder benzen:
C6H6 + HtoSW4 <-> C6H5SW3H + HtoELLER
ArH + HtoSW4 <-> ArSO3H + HtoELLER
Sulfonering er en reversibel reaksjon, for hvis vi tilfører fortynnet syre til benzensulfonsyre og sender damp over blandingen, genereres SO-eliminasjonsreaksjonen.3 og benzen destilleres gjennom fordampning med damp, og forskyver likevekten mot desulfonering.
Sulfoneringsmidlet kan også være klorsvovlsyre, sulfaminsyre eller sulfittioner..
Alkylsulfonsyrer
Disse fremstilles generelt ved sulfo-oksidasjon, det vil si behandling av alkylforbindelser med svoveldioksid SOto og oksygen Oto, eller direkte med svoveltrioksid SO3.
RH + 2SOto + ELLERto + HtoELLER <--> R-SO3H + HtoSW4
applikasjoner
Sulfonsyrer for overflateaktive stoffer og vaskemidler
Alkylbenzensulfonsyrer brukes til fremstilling av vaskemidler, som er en av de mest utbredte bruksområdene..
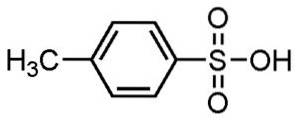
Brukes til pulver- og flytende vaskemidler, lette eller tunge vaskemidler, håndsåper og sjampo.
De aktive komponentene er generelt lineære alkylbenzensulfonater og sulfonerte fettestere..
Vanlige overflateaktive stoffer er alfa-olefinsulfonater, sulfobetainer, sulfosuccinater og alkyldifenyleterdisulfonater, som alle er avledet fra sulfonsyrer..
Disse overflateaktive stoffene finner anvendelse i husholdningsrengjøringsprodukter, kosmetikk, emulsjonspolymerisering og landbrukskjemisk produksjon..
Lignosulfonater er sulfonerte derivater av lignin, en komponent av tre, og brukes som dispergeringsmidler, fuktemidler, bindemidler i fortau, betongblandinger og tilsetningsstoffer i dyrefôr..
Et derivat av 2-naftalensulfonsyre brukes til å øke sementens flytbarhet og styrke..
Sulfonsyrebaserte fargestoffer
Disse er generelt karakterisert ved å inneholde azogrupper (R-N = N-R).
Fargestoffer avledet fra sulfonsyrer er nyttige i papirindustrien, blekk som blekkskriver, tekstiler som bomull og ull, kosmetikk, såper, vaskemidler, mat og lær..
Et derivat av 2-naftalensulfonsyre brukes også som en ingrediens i fargestoffer for polyesterfibre og for garvning av skinn..
Sulfonsyrebaserte amider
Akrylamidosulfonsyrer skiller seg ut i denne søknaden, som brukes i polymerer, ved elektrodeponering av metaller, som overflateaktive midler og i gjennomsiktige anti-tåke belegg..
De brukes også til forbedret oljeutvinning, som smittestoffer, i hydrauliske sementblandinger og som aminoplasthærdeakseleratorer..
Noen sulfonamider brukes også i insektmiddelformler.
Fluorerte og klorfluorerte sulfonsyrer
I denne gruppen er trifluormetansulfonsyre (CF3SW3H), også kalt triflic acid. Denne forbindelsen har anvendelse i organisk syntese og katalyse av polymerisasjonsreaksjoner.
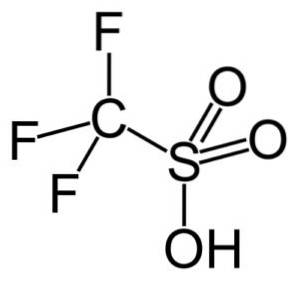
For eksempel blir den brukt i polymeriseringen av aromatiske olefiner og i fremstilling av høyt forgrenede parafiniske hydrokarboner med et høyt oktantal for bruk som drivstofftilsetningsstoffer..
En annen av dens anvendelser er i syntesen av ledende polymerer, gjennom doping av polyacetylen, og produserer for eksempel halvledertype s.
Pentafluoretansulfonsyre (CF3CFtoSW3H), kjent som pentafilsyre, brukes som en organisk katalysator.
Triflic syre reageres med antimon pentafluorid (SbF5) generering av den såkalte "Magic Acid", en supersyre katalysator som tjener til alkylering og polymerisering.
Nafion-H er en ionebytterharpiks av en perfluorert polymersulfonsyre. Det har karakteristikken av å være inert mot sterke syrer, sterke baser og reduksjons- eller oksidasjonsmidler..
I biologiske applikasjoner
En av de få sulfonsyrene som finnes i naturen er 2-aminoetansulfonsyre, bedre kjent som taurin, en essensiell aminosyre spesielt for katter..
Syntetisk og naturlig taurin brukes som kosttilskudd i kjæledyrmat og legemidler..
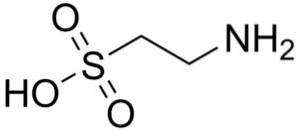
Taurocholic syre er en komponent av galle og deltar i fordøyelsen av fett. 8-Anilino-1-naftalensulfonsyre, en syntetisk forbindelse, brukes i studien av proteiner.
Kopolymerer av urea og bifenyldisulfonsyre har blitt brukt som hemmere av herpes simplex-viruset.
Noen derivater av sulfonsyrer, slik som sulfonert polystyren og noen azoforbindelser, har vist hemmende egenskaper av humant immunsviktvirus eller HIV, uten å være for giftige mot vertsceller.
I oljeindustrien
Visse blandinger av petroleumsderivater, som inkluderer en variert kombinasjon av aromater, parafiner og polynukleære aromater, kan sulfoneres og deretter nøytraliseres, og genererer såkalte petroleumssulfonater..
Disse petroleumsulfonatene har den egenskapen at de senker overflatespenningen til petroleum i vann. I tillegg er produksjonen veldig lav.
Av denne grunn injiseres petroleumssulfonater i eksisterende oljebrønner og hjelper utvinning av råolje som er fanget mellom bergarter under overflaten..
I formuleringen av smøremidler og korrosjonsmidler
Magnesiumsulfonater er mye brukt i smøremiddelformuleringer som vaskemiddel-dispergerende tilsetningsstoffer og for å forhindre slitasje..
Bariumsulfonater brukes i antifriksjonsbærende smøremidler som brukes i applikasjoner med høy hastighet. Natrium- og kalsiumsulfonater kan brukes i girsmøremidler og fett for å forbedre ekstreme trykkegenskaper.
Magnesiumsalter av sulfonsyrer er også nyttige i korrosjonshindrende anvendelser som belegg, fett og harpiks..
Referanser
- Falk, Michael og Giguere, Paul A. (1958). Om arten av svovelsyre. Canadian Journal of Chemistry, Vol. 36, 1958. Gjenopprettet fra nrcresearchpress.com
- Betts, R.H. og Voss, R.H. (1970). Kinetikken til oksygenutveksling mellom sulfittionen og vannet. Canadian Journal of Chemistry, Vol. 48, 1970. Gjenopprettet fra nrcresearchpress.com
- Bomull, F.A. og Wilkinson, G. (1980). Avansert uorganisk kjemi. Fjerde utgave. Kapittel 16. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volum 23. Fjerde utgave. John Wiley & Sons.
- Kosswig, Kurt. (2012). Surfaktanter. Ullmann's Encyclopedia of Industrial Chemistry Vol. 35. Wiley-VCH Verlag GmbH & Co.


Ingen har kommentert denne artikkelen ennå.