
Hydroiodic acid (HI) struktur, egenskaper og bruksområder

De hydroiodic syre Det er en vandig løsning av hydrogenjodid som er preget av høy surhet. En definisjon nærmere den kjemiske og IUPAC-terminologien er at det er et hydracid, hvis kjemiske formel er HI.
For å skille den fra gassformige hydrogenjodidmolekyler betegnes imidlertid HI (g) HI (aq). Det er av denne grunn at det i kjemiske ligninger er viktig å identifisere den medium eller fysiske fasen der reaktantene og produktene finnes. Allikevel er forvirring mellom hydrogenjodid og hydrojodsyre vanlig..
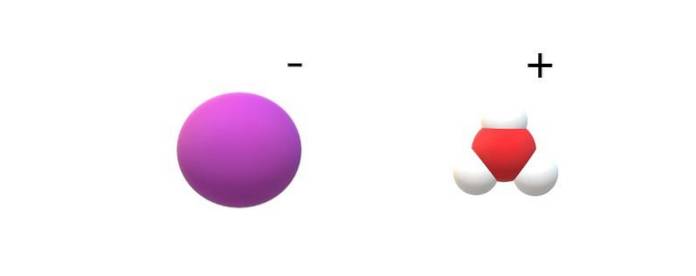
Hvis molekylene som er forpliktet i identiteten blir observert, vil det bli merkbare forskjeller mellom HI (g) og HI (ac). I HI (g) er det en H-binding; mens de er i HI (ac), er de faktisk et ionepar I- og H3ELLER+ samhandler elektrostatisk (toppbilde).
På den annen side er HI (ac) en kilde til HI (g), siden den første fremstilles ved å oppløse den andre i vann. På grunn av dette, kan HI brukes til å referere til hydrojodsyre, med mindre det er i en kjemisk ligning. HI er et sterkt reduksjonsmiddel og en utmerket kilde til I-ioner.- i vandig medium.
Artikkelindeks
- 1 Struktur av hydrojodsyre
- 2 eiendommer
- 2.1 Fysisk beskrivelse
- 2.2 Molekylær masse
- 2.3 Lukt
- 2.4 Tetthet
- 2.5 Kokepunkt
- 2,6 pKa
- 2.7 Surhet
- 2.8 Reduksjonsmiddel
- 3 Nomenklatur
- 4 bruksområder
- 4.1 Kilde til jod i organiske og uorganiske synteser
- 4.2 Reduksjonsmiddel
- 4.3 Cativa-prosess
- 4.4 Ulovlige synteser
- 5 Referanser
Struktur av hydrojodsyre
Hydrojodsyre består, som nettopp forklart, av en løsning av HI i vann. Å være i vann, skiller HI-molekylene seg fullstendig (sterk elektrolytt), med opprinnelse til I-ionene- og H3ELLER+. Denne dissosiasjonen kan representeres av følgende kjemiske ligning:
HI (g) + HtoO (l) => Jeg-(ac) + H3ELLER+(ac)
Hva ville være ekvivalent hvis det ble skrevet som:
HI (g) + HtoO (l) => HI (ac)
Imidlertid avslører HI (ac) ikke i det hele tatt hva som har skjedd med de gassformede HI-molekylene; det indikerer bare at de er i et vandig medium.
Derfor består den sanne strukturen til HI (ac) av ionene I- og H3ELLER+ omgitt av vannmolekyler som hydrerer dem; jo mer konsentrert hydroiodic syre, jo lavere antall ikke-fotonerte vannmolekyler.
Kommersielt er faktisk HI-konsentrasjonen 48 til 57% i vann; mer konsentrert vil være ekvivalent med å ha for gassende syre (og enda farligere).
På bildet kan det sees at anionen jeg- er representert av en lilla kule, og H3ELLER+ med hvite kuler og en rød for oksygenatomet. Kationen H3ELLER+ har trigonal pyramidemolekylgeometri (sett fra et høyere plan i bildet).
Eiendommer
Fysisk beskrivelse
Fargeløs væske; men den kan vise gulaktige og brune toner hvis den er i direkte kontakt med oksygen. Dette er fordi ionene jeg- ende opp med å oksidere til molekylært jod, jegto. Hvis det er mye jegto, det er mer enn sannsynlig at triiodidanionet dannes, I3-, som flekker løsningen brun.
Molekylær masse
127,91 g / mol.
Lukt
Acre.
Tetthet
Tettheten er 1,70 g / ml for 57% HI-oppløsningen; siden tetthetene varierer avhengig av de forskjellige konsentrasjonene av HI. Ved denne konsentrasjonen dannes en azeotrop (den destilleres som et enkelt stoff og ikke som en blanding) til hvis relative stabilitet det kan skyldes kommersialisering over andre løsninger..
Kokepunkt
57% HI-azeotropen koker ved 127 ° C ved et trykk på 1,03 bar (GO TO ATM).
pKa
-1,78.
Surhet
Det er en ekstremt sterk syre, så mye at den er etsende for alle metaller og stoffer; selv for gummi.
Dette er fordi H-bindingen er veldig svak, og den bryter lett under ionisering i vann. Videre bindes hydrogen I- - HOHto+ er svake, så det er ingenting å forstyrre H3ELLER+ reagere med andre forbindelser; det vil si H3ELLER+ har vært "gratis", som jeg- som ikke tiltrekker seg for mye kraft til motarbeidet hans.
Reduksjonsmiddel
HI er et kraftig reduksjonsmiddel, hvis viktigste reaksjonsprodukt er Ito.
Nomenklatur
Nomenklaturen for hydrojodsyre stammer fra det faktum at jod "virker" med en enkelt oksidasjonstilstand: -1. Og også, det samme navnet indikerer at det har vann innenfor sin strukturformel [I-] [H3ELLER+]. Dette er det eneste navnet, da det ikke er en ren forbindelse, men en løsning.
applikasjoner
Kilde til jod i organiske og uorganiske synteser
HI er en utmerket kilde til ioner- for uorganiske og organiske synteser, og er også et kraftig reduksjonsmiddel. For eksempel blir dens 57% vandige løsning brukt for syntese av alkyljodider (slik som CH3CHtoI) fra primære alkoholer. På samme måte kan en OH-gruppe erstattes av en I i en struktur.
Reduksjonsmiddel
Hydrojodsyre har blitt brukt for å redusere for eksempel karbohydrater. Hvis glukose oppløst i denne syren blir oppvarmet, vil den miste alle sine OH-grupper og oppnå hydrokarbon n-heksan som et produkt..
På samme måte har det blitt brukt til å redusere de funksjonelle gruppene av grafenark, på en slik måte at de kan funksjonaliseres for elektroniske enheter..
Cativa prosess

Fremgangsmåte
Prosessen begynner (1) med organo-iridium-komplekset [Ir (CO)toJegto]-, firkantet plan geometri. Denne forbindelsen "mottar" metyljodid, CH3I, produkt av forsuring av CH3OH med 57% HI. Vann produseres også i denne reaksjonen, og takket være den oppnås endelig eddiksyre, mens HI kan gjenvinnes i det siste trinnet..
I dette trinnet både gruppen -CH3 som -I de binder seg til iridiummetall-senteret (2) og danner et oktaedrisk kompleks med en fasett bestående av tre I-ligander. En av iodene blir til slutt erstattet av et molekyl karbonmonoksid, CO; og nå (3) har det oktaedriske komplekset en fasett sammensatt av tre CO-ligander.
Deretter skjer en omlegging: -CH-gruppen3 den "løsner" fra Ir og binder seg til tilstøtende CO (4) for å danne en acetylgruppe, -COCH3. Denne gruppen frigjøres fra iridiumkomplekset for å binde til jodidioner og gi CH3COI, acetyljodid. Her gjenvinnes iridiumkatalysatoren, klar til å delta i en annen katalytisk syklus.
Til slutt, CH3IOC gjennomgår en erstatning av jeg- per ett molekyl av HtoO, hvis mekanisme ender med å frigjøre HI og eddiksyre.
Ulovlige synteser

Det kan sees at en substitusjon av OH-gruppen for I skjer først, etterfulgt av en andre erstatning for en H.
Referanser
- Wikipedia. (2019). Hydrojodsyre. Gjenopprettet fra: en.wikipedia.org
- Andrews, Natalie. (24. april 2017). Bruken av hydriodic syre. Vitenskapelig. Gjenopprettet fra: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydronsyre. Gjenopprettet fra: alfa.com
- Nasjonalt senter for bioteknologisk informasjon. (2019). Hydronsyre. PubChem Database., CID = 24841. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Illustrert ordliste for organisk kjemi: Hydroiodic acid. Gjenopprettet fra: chem.ucla.edu
- Reusch William. (5. mai 2013). Karbohydrater. Gjenopprettet fra: 2.chemistry.msu.edu
- I Kyu Moon, Junghyun Lee, Rodney S. Ruoff og Hyoyoung Lee. (2010). Redusert grafenoksid ved kjemisk grafitisering. DOI: 10.1038 / ncomms1067.



Ingen har kommentert denne artikkelen ennå.