
Natriumcitrat (C6H5O7Na3) struktur, bruksområder, egenskaper
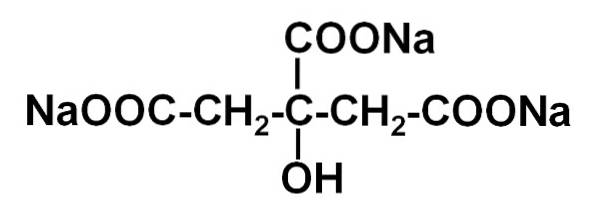
De natriumsitrat Det er natriumsaltet av sitronsyre. Den er dannet av et sitratanion C6H5ELLER73- og tre natrium-Na-kationer+. Molekylformelen er C6H5ELLER7Na3 eller i utvidet form: NaOOC-CHto-C (COONa) (OH) -CHto-COONa. Natriumsitrat er den konjugerte basen av sitronsyre, det vil si at den teoretisk erholdes fra sistnevnte ved å erstatte hvert H-proton+ av -COOH for et natrium-Na+.
Den kan fremstilles i vannfri form (uten vann i sammensetningen) eller i hydratisert form med 2 eller 5 vannmolekyler. Det er en forbindelse som når vannfri (uten vann) har en tendens til å absorbere vann fra miljøet.
Natriumsitrat fungerer som en buffer, dette betyr at det stabiliserer pH, som er et mål på surheten eller basiteten til en vandig løsning. Det har også egenskapen til å danne en stabil forbindelse med kalsium Ca-ioner.to+, kalsiumcitrat.
Den brukes for eksempel i næringsmiddelindustrien for å forhindre kumelk i å danne klumper som er vanskelige for spedbarn å fordøye.
I bioanalyselaboratorier brukes det til å forhindre at blodet som trekkes fra pasienter for visse tester koagulerer. Det forhindrer også at blod som brukes i transfusjoner koagulerer. Det brukes mye i fosfatfrie vaskemidler fordi det ikke er forurensende.
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Løselighet
- 3,5 pH
- 3.6 Kjemiske egenskaper
- 3.7 Andre egenskaper
- 4 Motta
- 4.1 Plassering i naturen
- 5 bruksområder
- 5.1 I næringsmiddelindustrien
- 5.2 I medisin
- 5.3 I legemiddelindustrien
- 5.4 I blodprøver
- 5.5 I syntesen av nanopartikler
- 5.6 I miljøvennlige vaskemidler
- 5.7 Forbedring av utnyttelsen av tjæresand
- 5.8 I andre applikasjoner
- 6 Referanser
Struktur
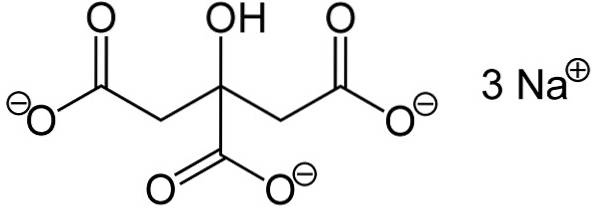
Trinatriumcitrat består av tre natrium-na-ioner+ og et sitration.
Sitrationet består av en kjede med tre karbonatomer som det er festet 3 karboksylater til -COO- (ett for hvert karbonatom) og et hydroksyl-OH ved det sentrale karbonet.
Hver av de 3 Na-ionene+ er tilknyttet en -COO-gruppe-.
Nomenklatur
- Natriumsitrat
- Trinatriumcitrat
- Trinatrium 2-hydroksypropan-1,2,3-trikarboksylat
Eiendommer
Fysisk tilstand
Hvitt eller fargeløst krystallinsk fast stoff.
Molekylær vekt
258,07 g / mol
Smeltepunkt
300 ºC
Løselighet
Det er veldig løselig i vann: 42,5 g / 100 ml ved 25 ºC. Det er praktisk talt uløselig i alkohol.
pH
En 5% vandig løsning av natriumcitrat har en pH mellom 7,5 og 9,0, det vil si at den er litt alkalisk.
Kjemiske egenskaper
Natriumsitrat er en buffer, noe som betyr at den stabiliserer pH, som er et mål på surhet eller alkalitet i en vandig løsning. Sitrat, ved å stabilisere pH, tillater ikke at løsningen forsures eller alkaliseres over visse verdier.
Når det er overflødige protoner H+ tar dem til å konvertere sine -COO-grupper- i -COOH-grupper. Omvendt, hvis det er mange OH-grupper- gir opp protonene til deres -COOH-grupper og konverterer dem til -COO-.
Når den transformeres av kroppen, gir den 3 molekyler HCO3- for hvert sitratmolekyl.
Andre egenskaper
Krystallene er delikatesser, det vil si at de absorberer vann fra luften. Natriumsitratdihydrat er mer stabil i luften.
Hvis dihydratet blir oppvarmet, blir det vannfritt (uten vann) når det når 150 ° C.
Som sitronsyre smaker natriumcitrat surt.
Å skaffe
Natriumsitrat lages vanligvis ved å tilsette natriumkarbonat til en sitronsyreoppløsning til brusen opphører. Brusingen skyldes utviklingen av karbondioksid COto:
NatoCO3 + Sitronsyre → Sodium citrate + COto↑
Deretter fordampes vannet fra løsningen for å krystallisere produktet.
Det kan også fremstilles ved å behandle en natriumsulfatoppløsning med kalsiumcitrat:
NatoSW4 + Kalsiumcitrat → Sodium citrate + CaSO4↓
Løsningen filtreres for å fjerne CaSO4 fast som har falt ut. Deretter konsentreres løsningen og dermed krystalliserer natriumcitratet.
Beliggenhet i naturen
Natriumsitrat er den konjugerte basen av sitronsyre, som er en naturlig forbindelse som finnes i alle levende organismer, siden den er en del av stoffskiftet, som er mekanismen for å utvikle energi i celler..
applikasjoner
I næringsmiddelindustrien
Natriumsitrat har forskjellige anvendelser i næringsmiddelindustrien, for eksempel som en surhetsregulator, sekvestrerende, stabilisator, overflateaktivt middel eller emulgator..
Den brukes blant annet i drinker, frosne desserter og spesielle oster.
Det gjør det mulig å unngå koagulering av melk, så den tilsettes kumelk som brukes til fôring av ammende barn. På denne måten skapes ikke blodpropp eller hard ostemasse som er vanskelig å fordøye av magen til barn..

Den brukes til å akselerere fargefiksering i herdet svinekjøtt eller biff, det vil si kjøtt som har blitt behandlet for å forhindre ødeleggelse. Opp til 50% askorbinsyre erstattes i disse.

Det brukes også til å forhindre blodpropp i fersk biff (som biffer).
I medisin
Det brukes som et alkaliserende middel, da det nøytraliserer overflødig syre i blod og urin. Det er indisert for å behandle metabolsk acidose som oppstår når kroppen produserer for mye syre.
Når det er inntatt, blir citrationet bikarbonation som er et systemisk alkaliserende middel (det vil si av hele organismen), og som en konsekvens blir H-ionene nøytralisert.+, øker pH i blodet og reverserer eller eliminerer acidose.
Sodium citrate fungerer som et nøytraliserende middel for en urolig mage.
Den brukes som slimløsende og sudorific. Den har vanndrivende virkning. Øker kalsiumutskillelsen i urinen, og det er derfor det brukes i hyperkalsemi, det er når det er et overskudd av kalsium i blodet.
Det tjener også til å lette fjerning av bly når blyforgiftning skjer..
Hvis det gis i overkant, kan det forårsake alkalose, muskelspasmer på grunn av funksjonsfeil i biskjoldbruskkjertelen og depresjon av hjertefunksjon på grunn av en reduksjon i nivået av kalsium i blodet, blant andre symptomer..
Natriumsitrat brukes i transfusjoner. Det tilsettes blodet sammen med dekstrose for å forhindre at det koagulerer.
Normalt metaboliserer leveren raskt sitratet som oppnås ved transfusjonen, men under transfusjoner av store mengder kan leverens kapasitet overskrides..
I slike tilfeller, siden sitrat danner et kompleks med kalsium, resulterer en reduksjon i kalsiumionen Ca.to+ i blodet. Dette kan føre til lyshet, skjelving, prikking, etc. Derfor må transfusjoner utføres sakte.
I legemiddelindustrien
Blant mange andre bruksområder brukes det til å forhindre mørkere medisiner der det er jern og tanniner.
I blodprøver
Det brukes som et antikoagulant i blodoppsamlingen eller når det må lagres, da det fungerer som en chelator av kalsium Ca-ionerto+, det vil si at den binder seg til kalsiumioner som danner kalsiumcitrat som ikke er ionisert.
Det brukes i koagulasjonstester og i å bestemme sedimenteringshastigheten til røde blodlegemer..
Det brukes som et antikoagulant under plasmaferese, en prosedyre for å fjerne overflødige stoffer som er skadelige for kroppen fra blodet..
I syntesen av nanopartikler
Den brukes som en stabilisator i syntesen av gullnanopartikler. Trinatriumcitratdihydrat tilsettes kloroaursyre og danner en vinrød suspensjon..
Natriumsitrat tjener som et reduksjonsmiddel og som et blodplatehemmende middel når det adsorberes på nanopartiklene..
På grunn av den negative ladningen av sitrat frastøter partiklene hverandre, og unngår agglomerering og danner en stabil dispersjon. Jo høyere sitratkonsentrasjonen er, desto mindre blir partiklene..
Disse nanopartiklene brukes til å forberede medisinske biosensorer.
I miljøvennlige vaskemidler
Natriumsitrat brukes mye i fosfatfrie flytende vaskemidler. Dette er fordi dets miljøatferd er ufarlig, siden det er en metabolitt som finnes i alle levende organismer..
Det er lett biologisk nedbrytbart og svakt giftig for vannlevende organismer. Av denne grunn anses det å være et rengjøringsmiddel med økologisk gunstige egenskaper..
I forbedring av utnyttelsen av tjæresand
Oljesand er sandformasjoner som er rike på bitumen eller tjære, et materiale som ligner på petroleum.
Natriumsitrat er vellykket testet i forbindelse med natriumhydroksid NaOH for å utvinne olje fra tjæresand.
Det antas at ved å forbinde sitratet med sandsteinen, -COO-ionene- Sitrat danner et stort antall negative ladninger på silikapartikler. Dette gir en bedre separasjon av sanden fra bitumen ved enkel avstøting av de negative ladningene av grusen fra de negative ladningene av bitumen.
I andre applikasjoner
Den brukes i fotografering, for å fjerne spormetaller, til galvanisering og for å fjerne SOto avfallsgasser.
Referanser
- OSS. National Library of Medicine. (2019). Natriumsitrat. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- McNamara, C. (2017). Innsamling og håndtering av blod. I Dacie og Lewis Praktisk hematologi (tolvte utgave). Gjenopprettet fra sciencedirect.com.
- Steber, J. (2007). Økotoksisiteten til rengjøringsproduktingredienser. I håndbok for rengjøring / dekontaminering av overflater. Gjenopprettet fra sciencedirect.com.
- Xiang, B. et al. (2019). Studie av rollen til natriumsitrat i frigjøring av bitumen. Energidrivstoff 2019, 33, 8271-8278. Gjenopprettet fra pubs.acs.org.
- Heddle, N. og Webert, K.E. (2007). Transfusjonsmedisin. In Blood Banking and Transfusion Medicine (Andre utgave). Gjenopprettet fra sciencedirect.com.
- Sudhakar, S. og Santhosh, P.B. (2017). Gull nanomaterialer. Fremskritt innen biomembraner og lipid selvmontering. Gjenopprettet fra sciencedirect.com.
- Elsevier (redaksjonell) (2018). Kapittel 8. Nanometal. I grunnleggende og anvendelser av nanosilisium i plasma og fulleriner. Nåværende og fremtidige trender Micro og Nano Technologies. Sider 169-203. Gjenopprettet fra sciencedirect.com.


Ingen har kommentert denne artikkelen ennå.