
Fordelingskoeffisient for fordeling, distribusjon, applikasjoner
De fordelingskoeffisient eller fordeling Det er definert som forholdet mellom konsentrasjonen av en kjemisk art eller løst stoff mellom to medier i likevekt. Dette mediet kan være en gass som luft; en væske som vann eller olje; eller en kompleks blanding slik som blod eller annet vev.
Fordelingskoeffisienten for blod / luft er viktig for å forklare gassutvekslingen som oppstår i lungene, mellom blodet og atmosfæren..
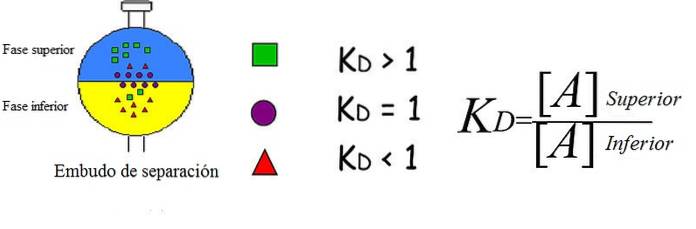
Bildet over demonstrerer på en forenklet og strålende måte konseptet forklarte. Hver figur representerer en analyt som er fordelt og / eller fordelt mellom to ikke-blandbare faser: den ene overlegen og den andre dårligere..
De grønne rutene er overveiende i den øvre fasen; mens de røde trekantene oppløses mer i den nedre fasen, og de lilla sirkler velger å være ved grensesnittet.
Du kan se hvordan K variererD for hver analyt. Hvis KD er større enn 1, vil analytten distribuere mer mot den øvre fasen; hvis verdien er nær 1, vil den ha en tendens til å være plassert på grensesnittet; eller om tvert imot KD er mindre enn 1, vil det hovedsakelig være i den nedre fasen.
En av formene på fordelingskoeffisienten er den mellom to ikke-blandbare væsker i likevekt; som er n-oktansystemet og vannet. Dette systemet har blitt brukt til å etablere en viktig egenskap for en forbindelse: dens hydrofobe eller hydrofile karakter..
Verdien av fordelingskoeffisienten (P), eller fordelingskoeffisienten (K), tjener til å indikere hydrofobisiteten til et medikament. Dermed kan den brukes til å forutsi dens tarmabsorpsjon, distribusjon, metabolisme og utskillelsesprosess..
Artikkelindeks
- 1 Fordelingskoeffisient
- 1.1 Definisjon
- 1.2 Tolkning
- 1.3 Fordelingskoeffisient for oktanol / vann
- 1.4 Begrensninger
- 2 Fordelingskoeffisient (D)
- 3 Eksperimentell bestemmelse av en fordelingskoeffisient
- 3.1 Rist kolbe-metoden
- 3.2 Høyytelses væskekromatografimetode
- 4 Søknader
- 4.1 Optimalisering av legemiddelaksjon
- 4.2 Landbrukskjemikalier
- 4.3 Omsorg for miljøet
- 5 Referanser
Fordelingskoeffisient
Definisjon
Partisjonskoeffisienten (K) til et stoff, også kalt partisjonskoeffisienten (P), er kvotienten for å dele konsentrasjonene av et stoff i to faser; består av blandingen av to løsningsmidler som ikke kan blandes på grunn av deres forskjellige tetthet og natur.
Verdien av fordelingskoeffisienten (K) eller fordelingen (P) er relatert til forskjellen i stoffets løselighet i de ublandbare væskene som inngår i blandingen.
K eller P = [substans]1 / [substans]to
[substans]1 er konsentrasjonen av stoffet i væske 1. Y [stoff]to er konsentrasjonen av det samme stoffet i væske 2.
Tolkning
Hvis K eller P har en verdi lik 3, indikerer det at stoffet er 3 ganger mer konsentrert i væske 1 enn i væske 2. Men samtidig indikerer det også at stoffet er mer løselig i væske 1.
Nå, hvis verdien av K eller P er 0,3, har stoffet en høyere konsentrasjon i væske 2; og derfor er dens løselighet større i væske 2 enn i væske 1.
Fordelingskoeffisient for oktanol / vann
I noen forskningsområder som organisk kjemi og farmasøytiske stoffer består blandingen av væsker av vann og en apolær væske som n-oktanol eller 1-oktanol, og det er grunnen til at oktanolfordelingskoeffisienten ofte blir referert til. / Vann representert av Pow.
N-oktanol har en tetthet på 0,824 g / cm3; mens vann, som kjent, har en tetthet på 1 g / cm3 omtrent konstant. Når de to væskene er balansert, opptar n-oktanolen den øvre delen av blandingen av ublandbare væsker, som har blitt kalt væske 1..
En hydrofob substans vil ha en høyere konsentrasjon i n-oktanol når de ikke-blandbare væskene er likevektige. På den annen side vil et hydrofilt stoff ha en høyere konsentrasjon i vann..
Begrensninger
Fordeling eller fordelingskoeffisient gjelder ikke-ioniserte stoffer. I tilfelle at fordelingskoeffisienten måles i et ioniserbart stoff, må pH justeres eller en buffer brukes i den vandige fasen for å sikre at stoffet fremstår som ikke-dissosiert.
Ved bestemmelse av fordelingskoeffisienten bør ikke overflateaktive stoffer eller overflateaktive stoffer brukes, siden disse stoffene på grunn av sin amfifile natur ligger i grensesnittet til ikke-blandbare væsker..
Fordelingskoeffisienten n-oktanol / vann uttrykkes vanligvis i logaritmisk form; det vil si som log P eller log K på grunn av amplituden til verdiene til P og K.
Hvis loggen til P for et stoff er større enn 0, er dette en indikasjon på at stoffet er hydrofobt. Tvert imot, hvis loggen til P er mindre enn 0 (det vil si negativ), vil dette indikere at stoffet er hydrofilt..
Fordelingskoeffisient (D)
Fordelingskoeffisienten (D) er kvotienten mellom konsentrasjonen av alle stoffer, ionisert og ikke-ionisert, i væske 1 (n-oktanol) og konsentrasjonen av de samme stoffene i væske 2 (vann).
Når verdien av fordelingskoeffisienten (D) er oppnådd, kan den uttrykkes som en logaritme av D på grunn av amplituden til verdiene til D.
For å oppnå fordelingskoeffisienten (D), må den vandige fasen bufres; det vil si ved en viss pH, som må angis når det refereres til verdien av den oppnådde fordelingskoeffisienten.
Det er praktisk å utføre bestemmelsen av D ved pH 7,4. Denne pH tilsvarer blodets og representerer tilstandene som medikamenter eller forbindelser vil møte i det intracellulære miljøet og i det ekstracellulære miljøet..
For en ikke-ioniserbar forbindelse, logg D = log P, uavhengig av pH som brukes.
Eksperimentell bestemmelse av en fordelingskoeffisient
Det er flere metoder for å måle fordelingskoeffisient (P). Disse inkluderer risteflaskemetoden og høyytelses væskekromatografi. Begge krever forkunnskaper om teststoffets løselighet, både i n-oktanol og i vann..
Rist kolbe-metoden
Prøven oppløses i n-oktanol mettet med vann, som vil bli fordelt i en skilletrekning eller dekanteringstrakt med vann mettet med n-oktanol. Metning av løsningsmidler er nødvendig for å unngå overføring av løsemiddel under oppdelingsprosessen.
Separasjonstrakten utsettes for mekanisk omrøring i en viss tid. Det blir da stående lenge for å sikre fullstendig separasjon. For å konkludere, er fasene skilt med dekantering.
Deretter bestemmes konsentrasjonen av prøven i hvert av løsningsmidlene ved hjelp av en spektrofotometrisk metode; f.eks. UV-synlig eller annen metode. Til slutt, med innhentede data, vil partisjonskoeffisienten og loggen P bli beregnet..
Denne metoden har fordelen av å være billig, reproduserbar og med høy presisjon. Oppsummert er det den mest pålitelige metoden for å bestemme logg P.
Den største ulempen med metoden er at den er veldig tidkrevende: mer enn 24 timer å utføre væskeekvilibrering, omrøring og faseseparasjon under oppdelingsprosessen. Videre gjelder den bare stoffer som er oppløselige i n-oktanol og vann..
Høyytelses væskekromatografimetode
Logg P kan oppnås ved å korrelere prøvenes retensjonstid med retensjonstiden til en referanseforbindelse med lignende kjemisk struktur med en kjent P-verdi..
Det er en metode der logg P-verdien oppnås i en tid på mindre enn 20 minutter. Det gir log p-verdier mellom 0 og 6, som kun tilsvarer hydrofobe stoffer.
Ulempen er at P-verdien bestemmes av lineær regresjon, så flere forbindelser med en kjemisk struktur som ligner prøven og kjente log P-verdier bør brukes som referanse..
applikasjoner
Optimalisering av legemiddelaksjon
Hvis et legemiddel inntas, må det nå tynntarmens lumen, der de fleste stoffene absorberes. Deretter går den gjennom det indre av cellene og oppløses i lipid-dobbeltlaget som er en del av membranen. Denne prosessen favoriseres av stoffets hydrofobe natur..
Legemidlet må passere gjennom tarmceller, krysse kjellermembranen for å nå blodet og nå målreseptorene for legemiddelhandling. Noen trinn i den generelle prosessen favoriseres av stoffets hydrofobe natur, men andre ikke..
Det må finnes en verdi av fordelingskoeffisienten som gjør at alle prosessene som er nødvendige for at legemidlet virker og kroppens velvære, er tilfredsstillende.
Bruk av overdrevent hydrofobe medikamenter kan være giftig, siden metabolismen kan produsere potensielt skadelige metabolitter. På den annen side gir totalt hydrofile medikamenter vansker for tarmabsorpsjon..
Landbrukskjemikalier
Aktiviteten til insektmidler og ugressmidler er påvirket av deres hydrofobe natur. Imidlertid er hydrofobisitet assosiert med lengre halveringstid. Derfor er den forurensende effekten på miljøet langvarig og kan forårsake økologisk skade..
Effektive hydrofobe produkter bør produseres med kortere halveringstid.
Miljøomsorg
Hydrofobe forbindelser er vanligvis forurensende stoffer for miljøet, siden de dreneres gjennom jorda og kan nå grunnvann og senere elvevann..
Å vite partisjonskoeffisienten til en forbindelse, kan endringer gjøres i dens kjemiske struktur som endrer dens hydrofobisitet for å redusere dens forurensende virkning på miljøet..
Hydrogeology bruker oktanol / vann-fordelingskoeffisienten (Kow) for å kontrollere strømmen av hydrofobe forbindelser, både i jord og i grunnvann.
Referanser
- Bannan, C. C., Calabró, G., Kyu, D. Y., & Mobley, D. L. (2016). Beregning av fordelingskoeffisienter for små molekyler i oktanol / vann og cykloheksan / vann. Tidsskrift for kjemisk teori og beregning, 12(8), 4015-4024. doi: 10.1021 / acs.jctc.6b00449
- Wikipedia. (2019). Fordelingskoeffisient. Gjenopprettet fra: es.wikipedia.org
- Nasjonalt universitet i Colombia. (s.f.). Enhet 8: Eksperimentell bestemmelse av barbituratfordelingskoeffisienten. [PDF]. Gjenopprettet fra: red.unal.edu.co
- The Sevier. (2019). Fordelingskoeffisient. Science Direct. Gjenopprettet fra: sciencedirect.com
- Seeboo Hemnath. (2019). Fordelingskoeffisient: Definisjon og beregning. Studere. Gjenopprettet fra: study.com


Ingen har kommentert denne artikkelen ennå.