
Dipole øyeblikk hvordan det beregnes og eksempler
De dipol øyeblikk er en kjemisk egenskap som indikerer hvordan heterogene elektriske ladninger fordeles i et molekyl. Det uttrykkes i Debye-enheter, 3,33 · 10-30 C · m, og generelt varierer dens verdier fra 0 til 11 D.
Meget polare forbindelser har en tendens til å ha store dipolmomenter; mens de apolære, små dipolmomenter. Jo mer polariserte de elektriske ladningene er i et molekyl, jo større er dipolmomentet; det vil si at det må være en region rik på elektroner, δ-, og en annen fattig på elektroner, δ+.

Dipolmomentet, μ, er en vektorstørrelse, så det påvirkes av bindingenes vinkler og generelt av molekylstrukturen.
Når molekylet er lineært, kan det sammenlignes med et tofarget viskelær. Dens negative ende δ-, tilsvarer fargen rød; mens det positive, δ +, ville være den blå fargen. Når størrelsen på de negative ladningene ved δ-polen øker, og avstanden som skiller den fra δ +, øker dipolmomentet.
Kjemisk betyr dette at jo større forskjell i elektronegativitet mellom to atomer, og jo lengre avstand som skiller dem, jo større er dipolmomentet mellom dem..
Artikkelindeks
- 1 Hvordan beregnes dipolmomentet?
- 2 Eksempler
- 2.1 Vann
- 2.2 Metanol
- 2.3 Ammoniakk
- 2.4 Etanol
- 2.5 Karbondioksid
- 2.6 Metan
- 3 Referanser
Hvordan beregner du dipolmomentet?
Det regnes som en kovalent binding mellom to atomer, A og B:
A-B
Avstanden mellom de positive og negative delladningene er allerede definert av lengden på obligasjonen deres:
TILδ+-Bδ-
Fordi protoner og elektroner har samme størrelsesorden elektrisk ladning, men med motsatte tegn, 1.6 · 10-19C, dette er den som tas i betraktning når man vurderer dipolmomentet mellom A og B ved hjelp av følgende ligning:
μ = δd
Hvor μ er dipolmomentet, δ er ladningen til elektronet uten negativt tegn, og d lengden på lenken uttrykt i meter. For eksempel forutsatt at d har en verdi på 2 Å (1 10-10m) dipolmomentet, μA-B vil være:
μA-B = (1,6 10-19C) · (2 · 10-10m)
= 3,210-29C m
Men siden denne verdien er veldig liten, brukes Debye-enheten:
μ = (3,210-29C · m) · (1 D / 3,33 · 10-30 C m)
= 9,60 D
Denne verdien av μA-B kan gi å anta at bindingen A-B er mer ionisk enn kovalent.
Eksempler
Vann
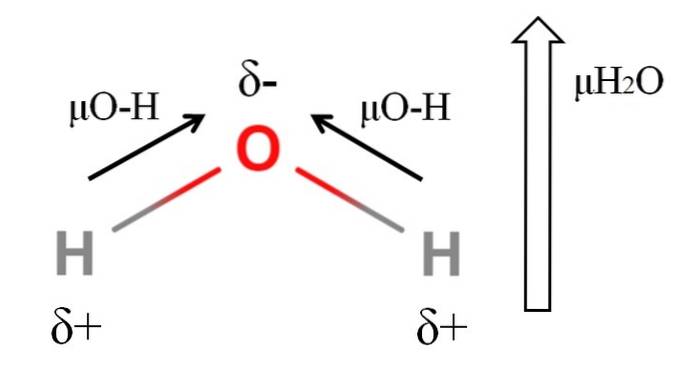
For å beregne dipolmomentet til et molekyl, må alle dipolmomentene til deres respektive bindinger tilsettes vektorielt, med tanke på bindingsvinklene og litt trigonometri. Dette i begynnelsen.
Vann har et av de største dipolmomentene som kan forventes for en kovalent forbindelse. I det øvre bildet har vi at hydrogenatomer har positive delladninger, δ +, mens oksygen bærer en negativ delvis ladning, δ-. O-H-bindingen er ganske polær (1,5D), og det er to av dem i et H-molekyltoELLER.
Vanligvis tegnes en vektor som er rettet fra det minste elektronegative atomet (H) til det mest elektronegative (O). Selv om de ikke er tegnet, er det på oksygenatomet to par ikke-delte elektroner, som ytterligere "konsentrerer" den negative regionen..
På grunn av H-vinkelgeometrientoEller dipolmomentene legger til i retning av oksygenatomet. Merk at summen av de to μO-H vil gi 3D (1,5 + 1,5); men det er ikke sånn. Dipolmomentet til vann har en eksperimentell verdi på 1,85D. Effekten av den nærmeste vinkelen på 105 ° mellom H-O-H-bindingene er vist her..
Metanol
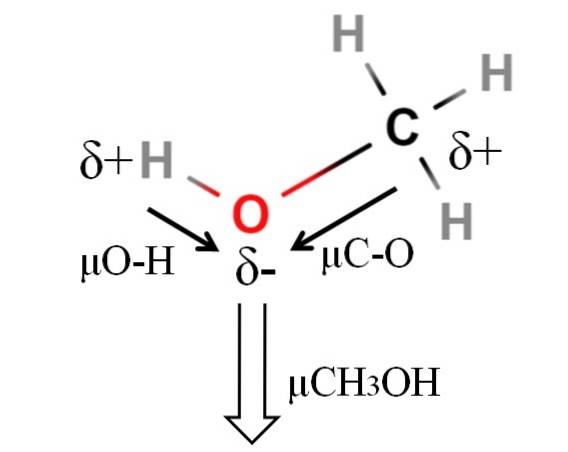
Dipolmomentet til metanol er 1,69 D. Det er mindre enn vann. Derfor har ikke atommassene stor innflytelse på dipolmomentet; men deres atomare radier er. Når det gjelder metanol, kan vi ikke bekrefte at H-bindingen har en μ lik 1,5D; siden molekylære miljøer er forskjellige i CH3OH og HtoELLER.
Derfor må lengden på H-O-bindingen i metanol måles for å beregne μO-H. Det som kan sies er at μO-H er større enn μC-O, siden elektronegativitetsforskjellen mellom karbon og oksygen er mindre enn mellom hydrogen og oksygen..
Metanol er oppført som et av de mest polare løsningsmidlene som finnes sammen med vann og ammoniakk..
Ammoniakk
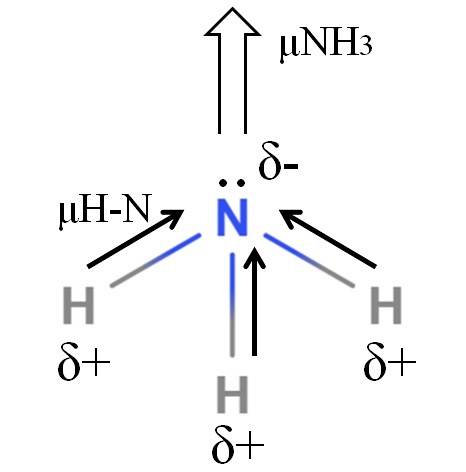
H-N-bindingene er ganske polare, så nitrogen tiltrekker elektroner mot seg selv på grunn av sin høyere elektronegativitet (øvre bilde). I tillegg til dette har vi et ikke-delt elektronpar som bidrar med deres negative ladninger til δ-regionen. Derfor dominerer elektriske ladninger på nitrogenatomet i ammoniakk..
Ammoniakk har et dipolmoment på 1,42 D, mindre enn metanol. Hvis både ammoniakk og metanol kunne transformeres til trekk, ville det sees at metanolutkastet har mer definerte poler sammenlignet med ammoniakkutkastet.
Etanol
Når det gjelder etanol, CH3CHtoOH, dens dipolmoment er veldig nær det for metanol, men det har en tendens til å ha lavere verdier. Ettersom det er flere karbonatomer som utgjør δ + -området, begynner oksygenatomet som representerer δ- å miste litt av sin "relative negative intensitet".
Karbondioksid
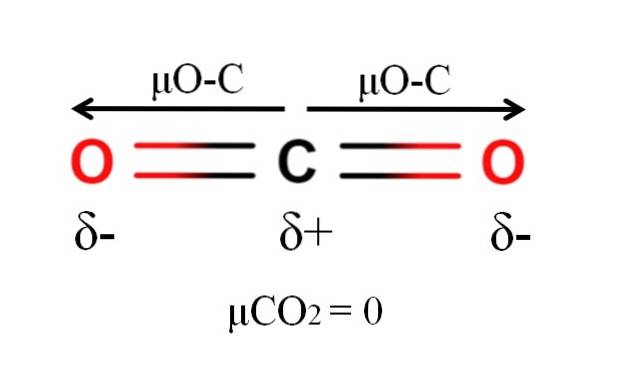
Karbondioksid har to polare bindinger, C = O, med deres respektive dipolmomenter μO-C. Imidlertid, som det kan sees på bildet ovenfor, er den lineære geometrien til COto får de to μO-C til å avbryte hverandre vektor, selv når karbon har en positiv delvis ladning og oksygener har negative delladninger.
Av denne grunn er karbondioksid et apolært molekyl, siden μCOto har en verdi på 0D.
Metan
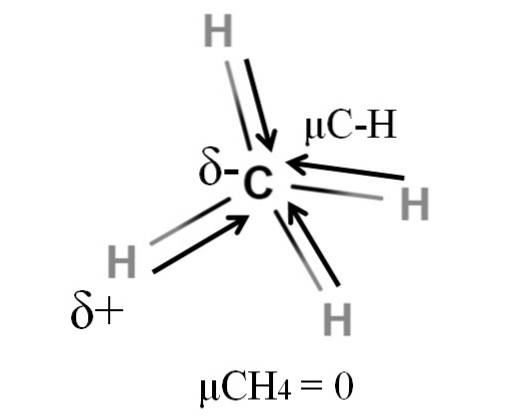
Både metan og karbondioksid har noe til felles: de er svært symmetriske molekyler. Generelt, jo mer symmetrisk et molekyl er, desto mindre er dipolmomentet..
Hvis vi ser CH-molekylet4, dens CH-bindinger er polære, og elektronene er rettet mot karbonatomet fordi det er litt mer elektronegativt. Man kan tenke at karbon må være et svært negativt δ-område; som et viskelær med sitt dyprøde sentrum og blåaktig ender.
Imidlertid ved å dele CH4 i halvparten ville vi få to HC-H-halvdeler, den ene til venstre og den andre til høyre, lik H-molekylettoO. Dermed vil dipolmomentet som følge av tilsetning av disse to μC-H avbrytes med det for den andre halvdelen. Og derfor, μCH4 har en verdi på 0D.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Walter J. Moore. (1963). Fysisk kjemi. I kjemisk kinetikk. Fjerde utgave, Longmans.
- Ira N. Levine. (2009). Prinsipper for fysisk-kjemi. Sjette utgave, s. 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (29. januar 2020). Dipole Moment Definisjon. Gjenopprettet fra: thoughtco.com
- Blaber Mike. (29. september 2019). Dipole øyeblikk. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- LaRita Williams. (2020). Dipole Moment: Definisjon, ligning og eksempler. Studere. Gjenopprettet fra: study.com
- Wikipedia. (2020). Bond dipol øyeblikk. Gjenopprettet fra: en.wikipedia.org



Ingen har kommentert denne artikkelen ennå.