
Enkel destillasjonsprosess og eksempler
De enkel destillasjon er en prosedyre der dampene som produseres fra en væske blir ført direkte til en kondensator, hvor temperaturen på dampene synker og kondensasjonen oppstår.
Den brukes til å skille en flyktig komponent fra de ikke-flyktige komponentene som er tilstede i en væske. Den brukes også til separering av to væsker som er tilstede i en løsning med veldig forskjellige kokepunkter..
Enkel destillasjon er ikke en effektiv metode for separering av to flyktige væsker som er tilstede i en løsning. Når temperaturen på den øker gjennom tilførsel av varme, øker også den kinetiske energien til molekylene, noe som gjør at de kan overvinne kohesjonskraften mellom dem..
Flyktige væsker begynner å koke når damptrykket deres tilsvarer det ytre trykket som utøves på overflaten av løsningen. Begge væskene bidrar til sammensetningen av den dannede dampen, jo mer flyktig væske er større; det vil si den med lavest kokepunkt.
Derfor utgjør den mer flyktige væsken det meste av destillatet som dannes. Prosessen gjentas til ønsket renhet eller høyest mulig konsentrasjon er nådd..
Artikkelindeks
- 1 Enkel destillasjonsprosess
- 1.1 Utstyr
- 1.2 Kondensator
- 1.3 Oppvarming
- 2 Eksempler
- 2.1 Destillasjon av vann og alkohol
- 2.2 Væske-faststoff-separasjon
- 2.3 Alkohol og glyserin
- 3 Referanser
Enkel destillasjonsprosess
Ved enkel destillasjon økes temperaturen til en løsning til den koker. I det øyeblikket skjer overgangen mellom væske til gassform. Dette observeres når en konstant bobling begynner i løsningen.
Team
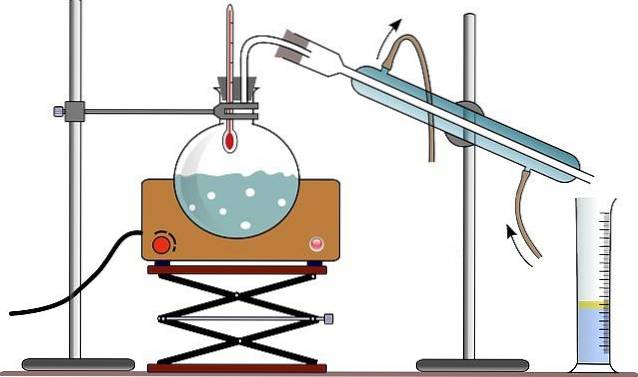
Utstyret for enkel destillasjon består vanligvis av en brenner eller et varmeteppe (se bilde); en rund ildfast glasskolbe med en malt glassmunn, slik at den kan kobles; og noen glassperler (noen bruker en trepinne) for å redusere størrelsen på boblene som dannes.
Glassperlene tjener som bobledannende kjerner, som lar væsken koke sakte, og unngår overoppheting som resulterer i dannelsen av en slags gigantiske bobler; i stand til og med å utvise en væskemasse ut av destillasjonskolben.
Festet til munnen på kolben er en ildfast adapter med tre munner, som er laget av malt glass. Den ene halsen er festet til destillasjonskolben, en annen hals er festet til kondensatoren, og den tredje halsen lukkes ved hjelp av en gummipropp..
På bildet mangler monteringen denne adapteren; og i stedet, gjennom den samme gummiproppen, er termometeret og en direkte kontakt til kondensatoren plassert.
Kondensator
Kondensatoren er en enhet designet for å oppfylle funksjonen som navnet indikerer: å kondensere dampen som beveger seg gjennom den. Gjennom den øvre munnen er den koblet til adapteren, og gjennom den nedre munnen er den koblet til en ballong der destillasjonsproduktene samles..
Når det gjelder bildet, bruker de (selv om det ikke alltid er riktig) en gradert sylinder for å måle destillert volum på en gang.
Vannet som sirkulerer gjennom den ytre kappen på kondensatoren, kommer inn i den gjennom den nedre delen og kommer ut gjennom den øvre delen. Dette sikrer at kondensatortemperaturen er lav nok til å tillate kondens av damper produsert i destillasjonskolben..
Alle delene som utgjør destillasjonsapparatet er festet med klemmer som er koblet til en metallstøtte.
Et volum av løsningen som skal destilleres plasseres i den runde kolben med passende kapasitet.
Riktig tilkobling er laget med grafitt eller fett for å sikre effektiv tetting, og oppvarming av løsningen begynner. Samtidig begynner passering av vann gjennom kondensatoren.
Oppvarming
Når destillasjonskolben varmes opp, observeres en økning i temperaturen på termometeret, til det når et punkt der temperaturen forblir konstant. Dette forblir slik selv om oppvarmingen fortsetter; med mindre all flyktig væske er fullstendig fordampet.
Forklaringen på denne oppførselen er at kokepunktet til komponenten med væskeblandingens laveste kokepunkt er nådd, hvor dens damptrykk tilsvarer det ytre trykket (760 mm Hg).
På dette tidspunktet blir all varmeenergi brukt i endringen fra flytende tilstand til gassform som involverer utløp av væskens intermolekylære kohesjonskraft. Derfor tilfører ikke varmetilførselen en økning i temperaturen..
Destillasjonens flytende produkt samles i riktig merkede kolber, hvis volum vil avhenge av volumet som opprinnelig ble plassert i destillasjonskolben..
Eksempler
Destillasjon av vann og alkohol
Du har en 50% alkohol i vannoppløsning. Å vite at alkoholens kokepunkt er 78,4 ° C og vannets kokepunkt er omtrent 100 ° C. Kan man da oppnå en ren alkohol med et enkelt destillasjonstrinn? Svaret er nei.
Ved å varme opp alkohol-vann-blandingen, oppnås innledningsvis kokepunktet for den mest flyktige væsken i dette tilfellet alkohol. Dampen som dannes vil ha en høyere andel av alkoholen, men det vil også være høy tilstedeværelse av vann i dampen, siden kokepunktene er like..
Væsken som samles opp fra destillasjonen og kondensasjonen vil ha en alkoholprosent som er større enn 50%. Hvis denne væsken utsettes for suksessive destillasjoner, kan en konsentrert alkoholoppløsning oppnås; men ikke rent, siden damper vil fortsette å trekke vann til en bestemt sammensetning og danne det som er kjent som en azeotrop
Det flytende produktet av gjæring av sukker har en alkoholprosent på 10%. Denne konsentrasjonen som kan bringes til 50%, som i tilfelle whisky, ved enkel destillasjon.
Væske-fast separasjon
En løsning av et salt i vann består av en væske som kan fordampes, og en ikke-flyktig forbindelse med høyt kokepunkt: salt..
Ved destillering av løsningen kan rent vann oppnås i kondensvæsken. I mellomtiden vil saltene legge seg på bunnen av destillasjonskolben.
Alkohol og glyserin
Det er en blanding av etylalkohol, med et kokepunkt på 78,4 ° C, og glyserin, med et kokepunkt på 260 ° C. Når den blir utsatt for enkel destillasjon, vil den dannede dampen ha en veldig høy andel alkohol, nær 100%..
Derfor vil en destillert væske bli oppnådd med en prosentandel alkohol, lik den for damp. Dette skjer fordi væskens kokepunkter er veldig forskjellige.
Referanser
- Claude Yoder. (2019). Destillasjon. Kablet kjemi. Gjenopprettet fra: wiredchemist.com
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Dragani, Rachelle. (17. mai 2018). Tre eksempler på enkle destillasjonsblandinger. Vitenskapelig. Gjenopprettet fra: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (2. januar 2019). Hva er destillasjon? Kjemi Definisjon. Gjenopprettet fra: thoughtco.com
- Welder. (s.f.). Enkel destillasjon. Gjenopprettet fra: dartmouth.edu
- Universitetet i Barcelona. (s.f.). Destillasjon. Gjenopprettet fra: ub.edu



Ingen har kommentert denne artikkelen ennå.