
Henderson-Hasselbalch ligning forklaring, eksempler, øvelse
De Henderson-Hasselbalch-ligning er et matematisk uttrykk som tillater beregning av pH i en buffer eller bufferløsning. Den er basert på syrenes pKa og forholdet mellom konsentrasjonen av konjugatbasen eller saltet og syren som er tilstede i bufferløsningen..
Ligningen ble opprinnelig utviklet av Lawrence Joseph Henderson (1878-1942) i 1907. Denne kjemikeren etablerte komponentene i ligningen hans basert på karbonsyre som en buffer eller buffer..
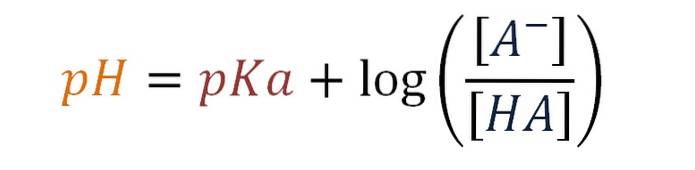
Senere introduserte Karl Albert Hasselbalch (1874-1962) i 1917 bruk av logaritmer for å utfylle Henderson-ligningen. Den danske kjemikeren studerte reaksjonene av blod med oksygen og effekten på pH.
En bufferløsning er i stand til å minimere pH-endringene som en løsning gjennomgår ved å tilsette et volum med sterk syre eller base. Den består av en svak syre og den sterke konjugerte basen som dissosierer raskt.
Artikkelindeks
- 1 Forklaring
- 1.1 Matematisk utvikling
- 1.2 Ligning for en svak base
- 2 Hvordan fungerer en buffer?
- 2.1 Demping
- 2.2 Bufferkapasitet
- 3 Eksempler på Henderson-ligninger
- 3.1 Acetatstøtdemper
- 3.2 Karbonsyrebuffer
- 3.3 Laktatbuffer
- 3.4 Fosfatbuffer
- 3.5 Oxyhemoglobin
- 3.6 Deoksyhemoglobin
- 4 Løst øvelser
- 4.1 Øvelse 1
- 4.2 Øvelse 2
- 4.3 Øvelse 3
- 5 Referanser
Forklaring
Matematisk utvikling
En svak syre i en vandig løsning dissosierer i henhold til loven om masseaksjon, i henhold til følgende skjema:
HA + HtoO ⇌ H+ + TIL-
HA er den svake syren og A.- dens konjugerte base.
Denne reaksjonen er reversibel og har en likevektskonstant (Ka):
Ka = [H+] ·[TIL-] / [HA]
Tar logaritmer:
logg Ka = logg [H+] + Logg [A-] - logg [HA]
Hvis hvert begrep i ligningen multipliseres med (-1), uttrykkes det som følger:
- logg Ka = - logg [H+] - logg [A] + logg [HA]
- loggen Ka er definert som pKa og - loggen [H+] er definert som pH. Etter å ha foretatt riktig erstatning, reduseres det matematiske uttrykket til:
pKa = pH - logg [A-] + Logg [HA]
Løsning av pH og omgruppering av uttrykk, er ligningen uttrykt som følger:
pH = pKa + log [A-] / [HA]
Dette er Henderson-Hasselbalch-ligningen for en svak syrebuffer.
Ligning for en svak base
Tilsvarende kan en svak base danne en buffer, og Henderson-Hasselbalch-ligningen for den er som følger:
pOH = pKb + log [HB] / [B-]
Imidlertid stammer de fleste bufferløsninger, selv de av fysiologisk betydning, fra dissosiasjonen av en svak syre. Derfor er det mest brukte uttrykket for Henderson-Hasselbalch-ligningen:
pH = pKa + log [A-] / [HA]
Hvordan fungerer en buffer?
Dempende handling
Henderson-Hasselbalch-ligningen indikerer at denne løsningen består av en svak syre og en sterk konjugatbase uttrykt som et salt. Denne sammensetningen tillater at bufferløsningen forblir på en stabil pH selv når sterke syrer eller baser tilsettes..
Når en sterk syre tilsettes bufferen, reagerer den med den konjugerte basen og danner et salt og vann. Dette nøytraliserer syren og lar pH-variasjonen være minimal..
Nå, hvis en sterk base blir tilsatt bufferen, reagerer den med den svake syren og danner vann og et salt, og nøytraliserer virkningen av den tilførte basen på pH. Derfor er pH-variasjonen minimal.
PH i en bufferløsning avhenger av forholdet mellom konsentrasjonen av konjugatbasen og den svake syren, og ikke av den absolutte verdien av konsentrasjonene av disse komponentene. En bufferløsning kan fortynnes med vann og pH vil være praktisk talt uendret.
Buffer kapasitet
Bufferkapasiteten avhenger også av pKa av den svake syren, så vel som konsentrasjonene av den svake syren og konjugatbasen. Jo nærmere pH i bufferen er til syrenes pKa, jo større er bufferkapasiteten..
På samme måte, jo høyere konsentrasjon av komponentene i bufferløsningen, jo større er bufferkapasiteten..
Eksempler på Henderson ligninger
Acetat støtdemper
pH = pKa + log [CH3COO-] / [CH3COOH]
pKa = 4,75
Karbonsyre buffer
pH = pKa + log [HCO3-] / [HtoCO3]
pKa = 6,11
Imidlertid er den totale prosessen som fører til dannelsen av bikarbonationen i en levende organisme som følger:
COto + HtoO ⇌ HCO3- + H+
Å være COto en gass, blir konsentrasjonen i løsningen uttrykt som en funksjon av dens delvise trykk.
pH = pka + log [HCO3-] / a pCOto
α = 0,03 (mmol / L) / mmHg
pCOto er partialtrykket til COto
Og så vil ligningen se ut som:
pH = pKa + log [HCO3-] / 0,03 pCOto
Laktatbuffer
pH = pKa + log [laktation] / [melkesyre]
pKa = 3,86
Fosfatbuffer
pH = pKa + log [dibasisk fosfat] / [monobasisk fosfat]
pH = pKa + log [HPO4to-] / [HtoPO4-]
pKa = 6,8
Oxyhemoglobin
pH = pKa + log [HbOto-] / [HHbOto]
pKa = 6,62
Deoksyhemoglobin
pH = pKa + log [Hb-] / HbH
pKa = 8,18
Løst øvelser
Øvelse 1
Fosfatbufferen er viktig for å regulere kroppens pH, siden pKa (6.8) er nær pH-verdien i kroppen (7.4). Hva vil være verdien av forholdet [NatoHPO4to-] / [NaHtoPO4-] av Henderson-Hasselbalch-ligningen for en pH-verdi = 7,35 og en pKa = 6,8?
NaH-dissosieringsreaksjonentoPO4- Det er:
NaHtoPO4- (syre) ⇌ NaHPO4to- (base) + H+
pH = pKa + log [NatoHPO4to-] / [NaHtoPO4-]
Å løse forholdet [konjugatbase / syre] for fosfatbufferen har vi:
7,35 - 6,8 = log [NatoHPO4to-] / [NaHtoPO4-]
0,535 = logg [NatoHPO4to-] / [NaHtoPO4-]
100,535 = 10logg [Na2HPO4] / [NaH2PO4]
3,43 = [NatoHPO4to-] / [NaHtoPO4-]
Øvelse 2
En acetatbuffer har en eddiksyrekonsentrasjon på 0,0135 M og en natriumacetatkonsentrasjon på 0,0260 M. Beregn pH i bufferen, vel vitende om at pKa for acetatbufferen er 4,75.
Dissosiasjonsvekt for eddiksyre er:
CH3COOH ⇌ CH3COO- + H+
pH = pKa + log [CH3COO-] / [CH3COOH]
Erstatter verdiene vi har:
[CH3COO-] / [CH3COOH] = 0,0260 M / 0,0135 M
[CH3COO-] / [CH3COOH] = 1,884
logg 1.884 = 0.275
pH = 4,75 + 0,275
pH = 5,025
Øvelse 3
En acetatbuffer inneholder 0,1 M eddiksyre og 0,1 M natriumacetat. Beregn pH i bufferen etter tilsetning av 5 ml 0,05 M saltsyre til 10 ml av løsningen ovenfor.
Det første trinnet er å beregne den endelige konsentrasjonen av HC1 når den blandes med bufferløsningen:
ViCi = VfCf
Cf = Vi · (Ci / Vf)
= 5 ml · (0,05 M / 15 ml)
= 0,017 M
Saltsyre reagerer med natriumacetat og danner eddiksyre. Derfor reduseres natriumacetatkonsentrasjonen med 0,017 M og eddiksyrekonsentrasjonen øker med samme mengde:
pH = pKa + log (0,1 M - 0,017 M) / (0,1 M + 0,017 M)
pH = pKa + log 0,083 / 0,017
= 4,75 - 0,149
= 4,601
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Jimenez Vargas og J. Mª Macarulla. (1984). Fysiologisk fysikkjemi. 6. utgave. Redaksjonell Interamericana.
- Wikipedia. (2020). Henderson-Hasselbalch-ligning. Gjenopprettet fra: en.wikipedia.org
- Gurinder Khaira og Alexander Kot. (5. juni 2019). Henderson-Hasselbalch tilnærming. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (29. januar 2020). Henderson Hasselbalch ligningsdefinisjon. Gjenopprettet fra: thoughtco.com
- Redaksjonen av Encyclopaedia Britannica. (6. februar 2020). Lawrence Joseph Henderson. Encyclopædia Britannica. Gjenopprettet fra: britannica.com


Ingen har kommentert denne artikkelen ennå.