
Kjemiske ligningsdeler og eksempler

De kjemisk ligning det er en skjematisk fremstilling av noen av egenskapene til en kjemisk reaksjon. Det kan også sies at den kjemiske ligningen beskriver endringene som de forskjellige stoffene som er involvert i en reaksjon.
Formlene og symbolene til de forskjellige deltakende stoffene er plassert i den kjemiske ligningen, og viser tydelig antall atomer for hvert element som er tilstede i forbindelsene, som fremstår som et abonnement og ikke kan endres ved å balansere ligningen.
Den kjemiske ligningen må fremstå som balansert, det vil si at antall atomer for både reaktanter og produkter må være like. På denne måten overholdes loven om bevaring av materie. Det er ønskelig at tallene som brukes til å balansere ligningene er hele tall.
Disse ligningene avslører ikke de påfølgende trinnene, og heller ikke av hvilke mekanismer reaktantene blir transformert til produkter..
Det er derfor, selv om de er veldig nyttige for å forstå hvor en kjemisk reaksjon går, tillater det oss ikke å forstå dens molekylære aspekter eller hvordan den påvirkes av visse variabler; som pH, viskositet, reaksjonstid, omrøringshastighet, blant andre.
Artikkelindeks
- 1 Deler av en kjemisk ligning
- 1.1 Plassering av reagenser og produkter
- 1.2 Balansere kjemiske ligninger
- 1.3 Fysiske tilstander til komponentene i den kjemiske ligningen
- 1.4 Endringer i fysisk tilstand
- 2 Eksempel på kjemiske ligninger
- 2.1 - Fotosyntese
- 2.2 - Cellulær respirasjon
- 2.3 - Reaksjoner av vanlige elementer
- 3 Referanser
Deler av en kjemisk ligning
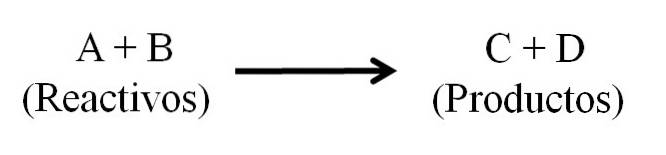
Det er i utgangspunktet tre hoveddeler til en kjemisk ligning: reaktantene, produktene og pilen som indikerer retningen til den kjemiske reaksjonen..
Plassering av reagenser og produkter
Alle stoffer som fungerer som reaktanter og alle de som er produkter, vises i den kjemiske ligningen. Disse stoffgruppene er atskilt med en pil som indikerer reaksjonsretningen. Reagenser er plassert til venstre for pilen og produkter til høyre.
Pilen betyr det som produseres og er orientert fra venstre mot høyre (→), selv om det i reversible reaksjoner er to likeverdige og parallelle piler; en rettet mot høyre og en mot venstre. Symbolet (Δ) er vanligvis plassert over pilen, noe som indikerer at varme ble brukt i reaksjonen..
I tillegg plasseres vanligvis katalysatoren på pilen, hvis mulig med formelen eller symbolet. De forskjellige stoffene som vises som reaktanter er atskilt med tegnet (+), noe som indikerer at stoffene reagerer eller kombineres med hverandre.
For stoffer som fremstår som produkter, har ikke tegnet (+) den forrige konnotasjonen; med mindre reaksjonen er reversibel. Det er praktisk at tegnet (+) plasseres like langt fra stoffene som det skiller.
Balansere kjemiske ligninger
Det er et viktig krav at de kjemiske ligningene er riktig balansert. For dette plasseres et tall kalt den støkiometriske koeffisienten. Når det er nødvendig, må denne koeffisienten gå før stoffene som vises som reaktanter eller produkter..
Dette er for å oppnå at antallet av alle atomene til elementene som vises som reaktanter er nøyaktig lik antall av dem som vises i produktet. Den enkleste metoden for å balansere kjemiske ligninger er prøving og feiling..
Fysiske tilstander til komponentene i den kjemiske ligningen
I noen kjemiske ligninger er stoffenes fysiske tilstand merket med et abonnement. For dette brukes følgende forkortelser på spansk: (s) for fast tilstand; (l) for flytende tilstand; (g), gassform; og (ac), vandig løsning.
Eksempel: omsetning av kalsiumkarbonat med saltsyre.
Tyv3 (r) + 2 HC1(ac) → CaCl2 (r) + HtoELLER(l) + CO2 g)
Endringer i fysisk tilstand
I noen tilfeller er det angitt i den kjemiske ligningen om det dannes en gass i den kjemiske reaksjonen, eller hvis det er utfelling av noen av de produserte stoffene..
Tilstedeværelsen av en gass er indikert av en vertikal pil med enden som peker oppover (↑), plassert på høyre side av gassstoffet.
Eksempel: omsetning av sink med saltsyre.
Zn + 2 HCl → ZnClto + Hto↑
Hvis et av stoffene i den kjemiske reaksjonen danner et bunnfall, symboliseres dette ved å plassere en vertikal pil med enden rettet nedover (↓), plassert på høyre side av det utfelte stoffet..
Eksempel: omsetning av saltsyre med sølvnitrat.
HCl + AgNO3 → HNO3 + AgCl ↓
Eksempel på kjemiske ligninger
- Fotosyntese

Fotosyntese er en prosess der planter fanger og transformerer lysenergi, som kommer fra sollys, for å generere den energien som er nødvendig for deres livsopphold. Fotosyntese utføres av noen organeller av planteceller som kalles kloroplaster.
Thylakoids finnes i kloroplastmembranen, steder der det finnes klorofyller. til Y b, som er de viktigste pigmentene som fanger lysenergi.
Selv om fotosyntese er en kompleks prosess, kan den skisseres i følgende kjemiske ligning:
6 COto + 6 timertoO → C6H12ELLER6 + 6 Oto↑ ΔGº = 2,870 kJ / mol
C6H12ELLER6 Det er formelen for glukose, et karbohydrat metabolisert for produksjon av ATP; forbindelse som er det viktigste reservoaret for energi i de fleste levende ting. I tillegg genereres NADPH fra glukose, et koenzym som er nødvendig for mange reaksjoner..
- Cellular respirasjon
Celler bruker oksygen til metabolismen av mange stoffer som er tilstede i inntatt mat. I mellomtiden brukes ATP som energikilde for aktivitetene som utføres av levende vesener, og produserer karbondioksid og vann i disse prosessene..
Hvis glukose brukes som en modell for et metabolisert stoff, kan respirasjon skjematiseres ved hjelp av følgende kjemiske ligning:
C6H12ELLER6 + 6 Oto → 6 COto + 6 timertoELLER
- Vanlige grunnreaksjoner
Nedbrytningsreaksjon
En forbindelse eller forbindelser dissosierer og danner andre forskjellige forbindelser med atomer:
2 KClO3 (r) → 2 KCl(s) + 3 O2 g)
Forskyvningsreaksjon
Et metall reagerer med en forbindelse, og erstatter et metall som er tilstede i det:
Mg(s) + KURS4 (ac) → Cu(s) + MgSO4 (ac)
Eliminasjonsreaksjon
I denne reaksjonstypen reduseres antall atomer eller grupper festet til et karbonatom:
CH3-CHtoBr + NaOH → HtoC = CHto + HtoO + NaBr
Hydreringsreaksjon
Det er en reaksjon der en forbindelse tilfører et vannmolekyl. Denne reaksjonen er viktig ved tilberedning av alkoholer:
HtoC = CHto + HtoO → HtoC-CHtoÅh
Nøytraliseringsreaksjon
En base eller alkali reagerer med en syre som produserer salt og vann:
HCl(ac) + NaOH(ac) → NaCl(ac) + HtoELLER(l)
Syntese reaksjon
I denne typen reaksjoner kombineres to eller flere stoffer for å skape en ny forbindelse:
2 Li(s) + Cl2 g) → 2 LiCl(s)
Dobbel forskyvningsreaksjon (metatese)
I denne typen reaksjon er det utveksling av positive og negative ioner for å danne nye forbindelser:
AgNO3 (ac) + NaCl(ac) → AgCl(s) + Eldre bror3 (ac)
Referanser
- Flores, J. (2002). Kjemi. Utgave 1det var. Redaksjonell Santillana
- Mathews, C. K., Van Holde, K. E., og Ahern, K. G. (2002). Biokjemi. 3det var Utgave. Utgiver Pearson Addison Wesley
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2019). Kjemisk ligning. Gjenopprettet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (20. september 2019). Hva er en kjemisk ligning? Gjenopprettet fra: thoughtco.com


Ingen har kommentert denne artikkelen ennå.