
Elektrolyse av vannprosedyre, teknikker, hva det er til
De elektrolyse av vann Det er nedbrytningen av vann til dets elementære komponenter gjennom påføring av en elektrisk strøm. Når du fortsetter, hydrogen og molekylært oksygen, Hto megto. Disse to overflatene er bedre kjent under navnet elektroder..
Teoretisk sett er volumet av Hto dannet må være dobbelt så stort som Oto. Hvorfor? Fordi vannmolekylet har et H / O-forhold lik 2, det vil si to H for hvert oksygen. Dette forholdet bekreftes direkte med sin kjemiske formel, HtoO. Imidlertid påvirker mange eksperimentelle faktorer volumene som oppnås.

Hvis elektrolysen utføres i rør nedsenket i vann (øvre bilde), tilsvarer den nedre vannkolonnen hydrogen, siden det er en større mengde gass som utøver trykk på overflaten av væsken. Boblene omgir elektrodene og ender med å stige etter å ha overvunnet vanndampen i vannet.
Merk at rørene er skilt fra hverandre på en slik måte at det er lav gassmigrasjon fra en elektrode til den andre. I lave skalaer representerer dette ikke en overhengende risiko; men på industrielle skalaer, den gassformige blandingen av Hto megto det er svært farlig og eksplosivt.
Av denne grunn er de elektrokjemiske cellene der elektrolyse av vann utføres veldig dyre; De trenger et design og elementer som sikrer at gasser aldri blandes, en kostnadseffektiv strømforsyning, høye konsentrasjoner av elektrolytter, spesielle elektroder (elektrokatalysatorer) og mekanismer for å lagre Hto produsert.
Elektrokatalysatorer representerer friksjon og samtidig vinger for lønnsomhet ved elektrolyse av vann. Noen består av edle metalloksider, som platina og iridium, hvis priser er veldig høye. Det er på dette punktet spesielt der forskere går sammen om å designe effektive, stabile og billige elektroder..
Årsaken til dette arbeidet er å akselerere dannelsen av Oto, som oppstår ved lavere hastigheter sammenlignet med Hto. Dette bremser av elektroden der O dannesto det bringer som en generell konsekvens anvendelse av et potensiale som er mye større enn nødvendig (overpotensial); hva er det samme, til lavere ytelse og høyere utgifter.
Artikkelindeks
- 1 Elektrolysereaksjon
- 1.1 Halvcellereaksjoner
- 2 Fremgangsmåte
- 3 teknikker
- 3.1 Elektrolyse med alkalisk vann
- 3.2 Elektrolyse med elektrolytisk polymermembran
- 3.3 Elektrolyse med faste oksider
- 4 Hva er elektrolyse av vann til?
- 4.1 Hydrogenproduksjon og dens bruk
- 4.2 Som en feilsøkingsmetode
- 4.3 Som oksygenforsyning
- 5 Hjemmeeksperiment
- 5.1 Hjemvariabler
- 6 Referanser
Elektrolysereaksjon
Elektrolyse av vann involverer mange komplekse aspekter. Generelt sett hviler imidlertid grunnlaget på en enkel global reaksjon:
2HtoO (l) => 2Hto(g) + Oto(g)
Som det fremgår av ligningen er to vannmolekyler involvert: den ene må vanligvis reduseres, eller få elektroner, mens den andre må oksidere eller miste elektroner..
Hto Det er et produkt av reduksjon av vann, siden gevinsten av elektroner fremmer at H-protonene+ kan binde kovalent, og oksygenet blir transformert til OH-. Derfor er Hto oppstår ved katoden, som er elektroden der reduksjon oppstår.
Mens Oto kommer fra oksidasjon av vann, på grunn av hvilket det mister elektronene som lar det binde seg til hydrogen, og frigjør følgelig protoner H+. Oto den produseres ved anoden, elektroden der oksidasjon skjer; og i motsetning til den andre elektroden, er pH rundt anoden sur og ikke basisk.
Halvcellereaksjoner
Dette kan oppsummeres med følgende kjemiske ligninger for halvcellereaksjoner:
2HtoO + 2e- => Hto + 2OH- (Katode, grunnleggende)
2HtoO => Oto + 4H+ + 4e- (Anode, syre)
Vann kan imidlertid ikke miste flere elektroner (4e-) hvorav det andre vannmolekylet vinner ved katoden (2e-); derfor må den første ligningen multipliseres med 2, og deretter trekkes fra den andre ligningen for å oppnå nettolikningen:
2 (2HtoO + 2e- => Hto + 2OH-)
2HtoO => Oto + 4H+ + 4e-
6HtoO => 2Hto + ELLERto + 4H+ + 4OH-
Men 4H+ og 4OH- skjema 4HtoEller så fjerner disse fire av de seks molekylene av HtoEller etterlater to; og resultatet er den globale reaksjonen som nettopp ble reist.
Halvcellereaksjoner endres med pH-verdier, teknikker og har også tilhørende reduksjons- eller oksidasjonspotensialer, som bestemmer hvor mye strøm som må tilføres for at elektrolysen av vann skal gå spontant..
Prosess
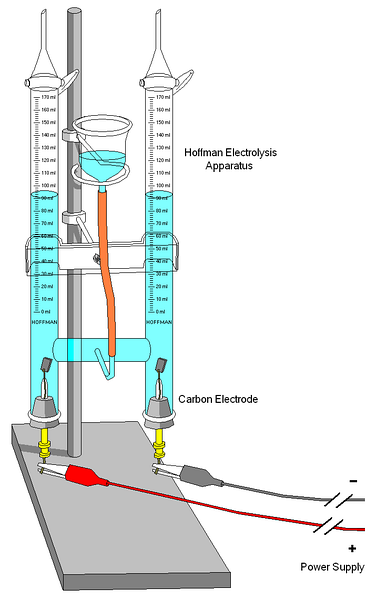
Et Hoffman voltameter er vist på bildet ovenfor. Sylindrene er fylt med vann og de valgte elektrolyttene gjennom den midterste dysen. Disse elektrolyttenes rolle er å øke ledningsevnen til vannet, fordi det under normale forhold er svært få H-ioner3ELLER+ og OH- produkter av sin egenionisering.
De to elektrodene er vanligvis platina, selv om de i bildet ble erstattet av karbonelektroder. Begge er koblet til et batteri, som en potensiell forskjell (AV) påføres som fremmer oksidasjonen av vann (dannelse av Oto).
Elektronene beveger seg hele kretsen til de når den andre elektroden, der vannet vinner dem og blir Hto og OH-. På dette punktet er anoden og katoden allerede definert, som kan skilles fra høyden på vannsøylene; den med lavest høyde, tilsvarer katoden der H dannesto.
På toppen av sylindrene er det nøkler som gjør at gassene som genereres frigjøres. Tilstedeværelsen av H kan kontrolleres nøyeto får den til å reagere med en flamme, hvis forbrenning produserer gassformig vann.
Teknikker
Vannelektrolyseteknikker varierer avhengig av mengden Hto megto som er foreslått å generere. Begge gassene er veldig farlige hvis de blandes sammen, og det er derfor elektrolytiske celler involverer komplekse design for å minimere økningen i gasstrykk og deres diffusjon gjennom det vandige mediet..
Likeledes varierer teknikkene avhengig av cellen, elektrolytten som tilsettes vannet og selve elektrodene. På den annen side antyder noen at reaksjonen utføres ved høyere temperaturer, noe som reduserer strømforbruket, og andre bruker enorme trykk for å opprettholde Hto lagret.
Blant alle teknikkene kan følgende tre nevnes:
Elektrolyse med alkalisk vann
Elektrolyse utføres med basiske løsninger av alkalimetallene (KOH eller NaOH). Med denne teknikken oppstår reaksjonene:
4HtoO (l) + 4e- => 2Hto(g) + 4OH-(ac)
4OH-(ac) => Oto(g) + 2HtoO (l) + 4e-
Som det kan sees, både ved katoden og ved anoden, har vann en basisk pH; og videre OH- migrere til anoden der de oksiderer til Oto.
Elektrolyse med polymer elektrolytisk membran
Denne teknikken bruker en solid polymer som fungerer som en permeabel membran for H+, men ugjennomtrengelig for gasser. Dette sikrer større sikkerhet under elektrolyse..
Halvcellereaksjonene for dette tilfellet er:
4H+(ac) + 4e- => 2Hto(g)
2HtoO (l) => Oto(g) + 4H+(ac) + 4e-
H-ioner+ migrere fra anoden til katoden, hvor de reduseres til å bli Hto.
Elektrolyse med faste oksider
Veldig forskjellig fra andre teknikker, denne bruker oksider som elektrolytter, som ved høye temperaturer (600-900 ° C) fungerer som et transportmiddel for å transportere anionen Oto-.
Reaksjonene er:
2HtoO (g) + 4e- => 2Hto(g) + 2Oto-
2Oto- => Oto(g) + 4e-
Merk at denne gangen er det oksidanionene, Oto-, de som reiser til anoden.
Hva er elektrolyse av vann til?
Elektrolyse av vann produserer Hto (g) og Oto (g). Omtrent 5% av hydrogengassen som produseres i verden er laget ved elektrolyse av vann.
Hto det er et biprodukt fra elektrolyse av vandige NaCl-løsninger. Tilstedeværelsen av salt forenkler elektrolyse ved å øke vannets elektriske ledningsevne.
Den samlede reaksjonen som finner sted er:
2NaCl + 2HtoO => Clto + Hto + 2NaOH
For å forstå den enorme betydningen av denne reaksjonen, vil noen av bruken av gassformige produkter bli nevnt; For på slutten av dagen er det disse som driver utviklingen av nye metoder for å oppnå elektrolyse av vann på en mer effektiv og grønn måte.
Av alle er det mest ønsket å fungere som celler som energisk erstatter bruken av forbrenning av fossilt brensel..
Hydrogenproduksjon og dens bruk
-Hydrogen produsert i elektrolyse kan brukes i den kjemiske industrien som virker i avhengighetsreaksjoner, i hydrogeneringsprosesser eller som et reduksjonsmiddel i reduksjonsprosesser..
-Likeledes er det viktig i noen handlinger av kommersiell betydning, for eksempel: produksjon av saltsyre, hydrogenperoksid, hydroksylaminer, etc. Det er involvert i syntesen av ammoniakk gjennom en katalytisk reaksjon med nitrogen.
-I kombinasjon med oksygen produserer den flammer med høyt kaloriinnhold, med temperaturer mellom 3000 og 3500 K. Disse temperaturene kan brukes til skjæring og sveising i metallindustrien, for vekst av syntetiske krystaller, produksjon av kvarts, etc..
-Vannbehandling: for høyt nitratinnhold i vann kan reduseres ved eliminering i bioreaktorer, der bakterier bruker hydrogen som energikilde
-Hydrogen er involvert i syntesen av plast, polyester og nylon. I tillegg er det en del av glassproduksjonen, noe som øker forbrenningen under baking..
-Reagerer med oksider og klorid av mange metaller, inkludert: sølv, kobber, bly, vismut og kvikksølv for å produsere rene metaller.
-Og i tillegg brukes det som drivstoff i kromatografisk analyse med en flammedetektor..
Som en feilsøkingsmetode
Elektrolyse av natriumkloridløsninger brukes til å rense bassengvann. Under elektrolyse produseres hydrogen ved katoden og klor (Clto) ved anoden. Elektrolyse er i dette tilfellet referert til som en saltklorinator.
Klor oppløses i vann for å danne hypoklorsyre og natriumhypokloritt. Hypoklorsyre og natriumhypokloritt steriliserer vann.
Som oksygenforsyning
Elektrolyse av vann brukes også til å generere oksygen på den internasjonale romstasjonen, som tjener til å opprettholde en oksygenatmosfære i stasjonen..
Hydrogen kan brukes i en brenselcelle, en metode for å lagre energi, og bruke vannet som genereres i cellen til forbruk av astronauter.
Hjemmeeksperiment
Vannelektrolyseeksperimenter er utført på laboratorievekter med Hoffman voltmetre, eller en annen enhet som gjør det mulig å inneholde alle nødvendige elementer i en elektrokjemisk celle..
Av alle mulige samlinger og utstyr kan det enkleste være en stor gjennomsiktig vannbeholder, som vil tjene som en celle. I tillegg til dette, må en hvilken som helst metall eller elektrisk ledende overflate også være tilgjengelig for å fungere som elektroder; den ene for katoden, og den andre for anoden.
For dette formålet kan selv blyanter med skarpe grafittips i begge ender være nyttige. Og til slutt, et lite batteri og noen kabler som kobler det til de improviserte elektrodene..
Hvis det ikke blir utført i en gjennomsiktig beholder, vil dannelsen av gassformede bobler ikke bli verdsatt..
Hjemvariabler
Selv om elektrolyse av vann er et emne som inneholder mange spennende og håpefulle aspekter for de som leter etter alternative energikilder, kan hjemmeforsøket være kjedelig for barn og andre tilskuere..
Derfor kan tilstrekkelig spenning påføres for å generere dannelsen av Hto megto alternerende visse variabler og merke endringene.
Den første av disse er variasjonen av pH i vannet, ved hjelp av enten eddik for å forsure vannet, eller NatoCO3 for å gjøre det litt grunnleggende. Det må forekomme en endring i antall observerte bobler.
I tillegg kan det samme eksperimentet gjentas med varmt og kaldt vann. På denne måten vil effekten av temperatur på reaksjonen bli vurdert..
Til slutt, for å gjøre datainnsamlingen litt mindre fargeløs, kan en veldig fortynnet løsning av lilla kåljuice brukes. Denne juice er en syre-base indikator av naturlig opprinnelse.
Når du legger den til beholderen med de innsatte elektrodene, vil det bli lagt merke til at ved anoden blir vannet rosa (syre), mens fargen vil være gul (grunnleggende) ved katoden..
Referanser
- Wikipedia. (2018). Elektrolyse av vann. Gjenopprettet fra: en.wikipedia.org
- Chaplin M. (16. november 2018). Elektrolyse av vann. Vannstruktur og vitenskap. Gjenopprettet fra: 1.lsbu.ac.uk
- Energieffektivitet og fornybar energi. (s.f.). Hydrogenproduksjon: elektrolyse. Gjenopprettet fra: energy.gov
- Phys.org. (14. februar 2018). Høyeffektiv, billig katalysator for vannelektrolyse. Gjenopprettet fra: phys.org
- Kjemi LibreTexts. (18. juni 2015). Elektrolyse av vann. Gjenopprettet fra: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. og S. Lewis N. (2016). Prinsipper og implementeringer av elektrolysesystemer for vannsplitting. The Royal Society of Chemistry.
- Regenter ved University of Minnesota. (2018). Elektrolyse av vann 2. University of Minnesota. Gjenopprettet fra: chem.umn.edu


Ingen har kommentert denne artikkelen ennå.