
Tertiær struktur av de viktigste karakteristiske proteinene
De tertiær struktur av proteiner Det er den tredimensjonale konformasjonen som polypeptidkjeder får når de bretter seg på seg selv. Denne konformasjonen vises ved interaksjoner mellom sidekjedene til aminosyrerester av polypeptidet. Sidekjeder kan samhandle uavhengig av deres posisjon i proteinet.
Fordi det avhenger av samspillet mellom R-gruppene, viser den tertiære strukturen ikke-repeterende aspekter av kjeden, siden disse gruppene er forskjellige for hver aminosyrerest. Den sekundære strukturen, derimot, avhenger av karboksyl- og aminogruppene, som er tilstede i alle aminosyrer.
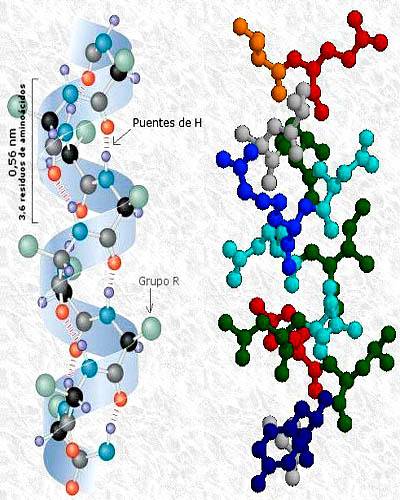
Tertiær struktur av proteinkinase fosfatase, med sekundære strukturer i alfa helix og beta ark. Tatt og redigert fra: A2-33. Modifisert av Alejandro Porto. [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)].
Noen forfattere antyder at fibrøse proteiner har en enkel tertiær struktur, men likevel påpeker andre forfattere at denne strukturen er typisk for kuleproteiner..
Artikkelindeks
- 1 Fiberholdige proteiner
- 1.1 α-keratiner
- 1.2 β-keratiner
- 1.3 Kollagen
- 1.4 Andre fibrøse proteiner
- 2 Globulære proteiner
- 2.1 Kjennetegn på den tertiære strukturen til kuleproteiner
- 2.2 Generelle regler for folding av kuleproteiner
- 3 Protein denaturering
- 4 Referanser
Fiberholdige proteiner
I fiberholdige proteiner er polypeptidkjedene arrangert i form av lange filamenter eller lange ark; de består vanligvis av en enkelt type sekundær struktur. Denne sekundære strukturen er i de fleste tilfeller viktigere enn den tertiære strukturen for å bestemme formen på proteinet..
Den biologiske funksjonen er strukturell, og gir styrke og / eller elastisitet til organene og strukturene der de finnes, samtidig som de holder dem sammen. Alle fibrøse proteiner er uoppløselige i vann på grunn av den store mengden hydrofobe aminosyrerester de presenterer.
Disse fibrøse proteinene inkluderer keratiner og kollagen. Førstnevnte finnes i bindevev og i strukturer som hår, negler (α-keratiner), skjell og fjær (β-keratiner). Kollagen finnes på sin side blant annet i bein, sener og hud.
α-keratiner
Disse proteinene er en del av de såkalte mellomstore filamentproteinene, som spiller en viktig rolle i cytoskelettet til flercellede organismer. I tillegg er de hovedbestanddelene av hår, negler, ull, horn, hover og et av hovedproteinene i dyrehud..
Strukturen til molekylet er en α-spiral. To α-keratin-tråder kan ordnes parallelt og vikles hverandre med deres hydrofobe R-grupper som samhandler med hverandre. På denne måten opprettes en superhelisk struktur eller ball med en venstre vikling..
Den tertiære strukturen til α-keratin er enkel og domineres av den sekundære strukturen til α-helix. På den annen side er den kvaternære strukturen også til stede, siden to molekyler deltar i den superheliske strukturen, som interagerer gjennom ikke-kovalente bindinger..
β-keratiner
Den primære strukturen er lik den for α-keratiner, men den sekundære strukturen domineres av β-ark. De er hovedbestanddelen av reptilskjell og fuglefjær..
Kollagen
Dette proteinet kan representere mer enn 30% av den totale proteinmassen til noen dyr. Finnes blant annet i brusk, bein, sener, hornhinnen og huden.
Den sekundære strukturen til kollagen er unik, og representeres av en venstrehendt spiral med 3,3 aminosyrerester for hver sving. Tre venstrehendte spiralkjeder (α-kjeder) brytes rundt hverandre, noe som gir et høyrehendt supercoiled molekyl, kjent av noen forfattere som tropokollagen..
Tropokollagenmolekyler samles for å danne en kollagenfiber som har høy styrke, bedre enn stål og som kan sammenlignes med høystyrke kobber.
Andre fibrøse proteiner
Andre typer fibrøse proteiner er fibroin og elastin. Den første består av β-ark, hovedsakelig bestående av glycin, alanin og serin..
Sidekjedene til disse aminosyrene er små i størrelse, slik at de kan pakkes tett. Resultatet er en fiber som både er veldig motstandsdyktig og veldig lite utvidbar..
I elastin erstatter valin serin blant de viktigste bestanddelene av aminosyrene. I motsetning til fibroin er elastin veldig utvidbart, derav navnet. I sammensetningen av molekylet virker også lysin, som kan delta i tverrbindinger som gjør at elastin kan få tilbake sin form når spenningen opphører..
Globulære proteiner
Globulære proteiner, i motsetning til fibrøse, er oppløselige og har generelt flere typer sekundære strukturer. Imidlertid er de tredimensjonale konformasjonene som de får når de brettes på seg selv, viktigere (tertiær struktur).
Disse spesielle tredimensjonale konformasjonene gir hvert protein spesifikk biologisk aktivitet. Hovedfunksjonen til disse proteinene er regulatorisk, slik det oppstår med enzymer.
Kjennetegn på den tertiære strukturen til kuleproteiner
Den tertiære strukturen til kuleproteiner har noen viktige egenskaper:
- Globulære proteiner er kompakte takket være pakking ved å brette polypeptidkjeden.
- De fjerne aminosyrerestene i den primære strukturen til polypeptidkjedene holder seg tett sammen, og er i stand til å samhandle med hverandre på grunn av foldingen.
- Større kuleproteiner (mer enn 200 aminosyrer) kan ha flere kompakte segmenter, uavhengig av hverandre og med bestemte funksjoner, og hvert av disse segmentene kalles et domene. Et domene kan ha mellom 50 og 350 aminosyrerester.
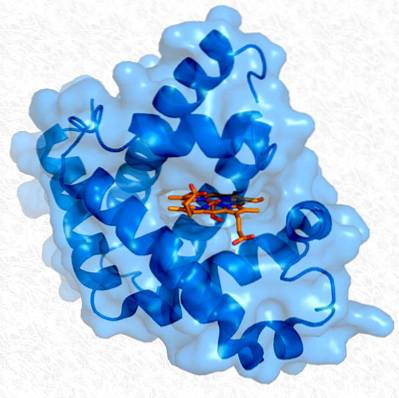
Tertiær struktur av myoglobin. Tatt og redigert fra: Thomas Splettstoesser. Modifisert av Alejandro Porto. [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)].
Generelle regler for bretting av kuleproteiner
Som allerede påpekt, presenterer proteiner spesielle former for folding, som også gir dem spesielle egenskaper. Denne brettingen er ikke tilfeldig og favoriseres både av den primære og sekundære strukturen og av noen ikke-kovalente interaksjoner, og det er også noen fysiske begrensninger for brettingen, som det er formulert noen regler for:
- Alle kuleproteiner har definerte fordelingsmønstre, med de hydrofobe R-gruppene rettet mot det indre av molekylet og de hydrofile rester i det ytre laget. Dette krever minst to lag sekundær struktur. Β-α-β-sløyfen og α-α-toppunktet kan gi disse to lagene.
- Β-arkene er vanligvis ordnet i en venstrehåndet rullet form..
- I en polypeptidkjede kan forskjellige svinger oppstå for å passere fra en sekundær struktur til en annen, slik som β- eller γ-svinger, som kan reversere kjederetningen med fire aminosyrerester eller mindre..
- Globulære proteiner har α-helices, β-ark, svinger og uregelmessig strukturerte segmenter.
Protein denaturering
Hvis et protein mister sin opprinnelige (naturlige) tredimensjonale struktur, mister det sin biologiske aktivitet og de fleste av sine spesifikke egenskaper. Denne prosessen er kjent under navnet denaturering.
Denaturering kan oppstå når naturlige miljøforhold endres, for eksempel ved varierende temperatur eller pH. Prosessen er irreversibel i mange proteiner; andre kan imidlertid spontant gjenvinne sin naturlige struktur når normale miljøforhold gjenopprettes..
Referanser
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biokjemi. 3. utgave. Benjamin / Cummings Publishing Company, Inc.
- R. Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper's Biochemestry. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biokjemi. 5. utgave. W. H. Freeman and Company.
- W.M. Becker, L.J. Kleinsmith & J. Hardin (2006) World of the Cell. 6. utgave. Pearson Education Inc..
- A. Lehninger (1978). Biokjemi. Ediciones Omega, S.A.
- T. McKee & J.R. McKee (2003). Biokjemi: Molekylær basis i livet. 3. utgave. McGraw-HiII Companies, Inc..



Ingen har kommentert denne artikkelen ennå.