
Fluorhistorie, egenskaper, struktur, oppnåelse, risiko, bruk
De fluor Det er et kjemisk element som er representert ved symbolet F og hodegruppe 17, som halogener tilhører. Det skilles ut over de andre elementene i det periodiske systemet, for å være det mest reaktive og elektronegative; reagerer med nesten alle atomer, så den danner utallige salter og organfluorerte forbindelser.
Under normale forhold er det en lysegul gass, som kan forveksles med gulgrønn. I flytende tilstand, vist på bildet nedenfor, forsterkes den gule fargen litt mer, som forsvinner helt når den stivner ved frysepunktet..

Slik er reaktiviteten, til tross for gassens ustabile natur, at den forblir fanget i jordskorpen; spesielt i form av mineralet fluoritt, kjent for sine fiolette krystaller. På samme måte gjør reaktiviteten det til et potensielt farlig stoff; reagerer kraftig på alt den berører og brenner i flammer.
Imidlertid kan mange av dets biprodukter være ufarlige og til og med fordelaktige, avhengig av deres applikasjoner. For eksempel er den mest populære bruken av fluor, tilsatt i sin ioniske eller mineralform (som fluorsalter), tilberedning av fluortannkremer, som hjelper til med å beskytte tannemaljen..
Fluor har den særegenheten at den kan stabilisere de høye tallene eller oksidasjonstilstandene for mange andre elementer. Jo høyere antall fluoratomer, jo mer reaktiv er forbindelsen (med mindre den er en polymer). Likeledes vil effekten av molekylære matriser øke; på godt og vondt.
Artikkelindeks
- 1 Historie
- 1.1 Bruk av fluoritt
- 1.2 Fremstilling av flussyre
- 1.3 Isolasjon
- 1.4 Interesse for fluor
- 2 Fysiske og kjemiske egenskaper
- 2.1 Utseende
- 2.2 Atomnummer (Z)
- 2.3 Atomvekt
- 2.4 Smeltepunkt
- 2.5 Kokepunkt
- 2.6 Tetthet
- 2.7 Fordampningsvarme
- 2.8 Molar varmekapasitet
- 2.9 Damptrykk
- 2.10 Varmeledningsevne
- 2.11 Magnetisk rekkefølge
- 2.12 Lukt
- 2.13 oksidasjonstall
- 2.14 Ioniseringsenergi
- 2.15 Elektronegativitet
- 2.16 Oksidasjonsmiddel
- 2.17 Reaktivitet
- 3 Struktur og elektronisk konfigurasjon
- 3.1 Diatomisk molekyl
- 3.2 Flytende og fast
- 4 Hvor å finne og skaffe
- 4.1 Fluorittbehandling
- 4.2 Elektrolyse av hydrogenfluorid
- 5 isotoper
- 6 Biologisk rolle
- 7 Risiko
- 7.1 Tannfluorose
- 7.2 Skjelettfluorose
- 8 bruksområder
- 8.1 Tannkrem
- 8.2 Vannfluorisering
- 8.3 Oksidasjonsmiddel
- 8.4 Polymerer
- 8.5 Apotekere
- 8.6 Glassetsing
- 8.7 Berikelse av uran
- 9 Referanser
Historie
Bruk av fluoritt
I 1530 oppdaget den tyske mineralogen Georgius Agricola at mineralet fluorspar kunne brukes til rensing av metaller. Fluorspar er et annet navn for fluoritt, et fluormineral som besto av kalsiumfluorid (CaFto).
Elementet fluor hadde ikke blitt oppdaget da, og "fluoiren" i fluoritt kom fra det latinske ordet "fluere" som betyr "å strømme"; siden dette var nøyaktig hva fluorspar eller fluoritt gjorde med metaller: det hjalp dem med å forlate prøven.
Fremstilling av flussyre
I 1764 lyktes Andreas Sigismud Margraff i å fremstille flussyre, og varme opp fluoritt med svovelsyre. Glassretortene ble smeltet av syrenes virkning, så glasset ble erstattet av metaller.
Det tilskrives også Carl Scheele i 1771, fremstillingen av syren etter samme metode fulgt av Margraff. I 1809 foreslo den franske forskeren Andre-Marie Ampere at fluor- eller flussyre var en forbindelse som består av hydrogen og et nytt grunnstoff som ligner på klor..
Forskere prøvde å isolere fluor ved å bruke flussyre i lang tid; men farligheten gjorde fremgangen i denne forstand vanskelig.
Humphry Davy, Joseph Louis Gay-Lussac og Jacques Thénard hadde sterke smerter da de inhalerte hydrogenfluorid (flussyre uten vann og i gassform). Forskerne Paulin Louyet og Jerome Nickles døde av forgiftning under lignende omstendigheter.
Edmond Frémy, en fransk forsker, prøvde å lage tørr flussyre for å unngå toksisitet for hydrogenfluorid ved å forsure kaliumbifluorid (KHFto), men under elektrolysen var det ingen ledning av den elektriske strømmen.
Isolering
I 1860 forsøkte den engelske kjemikeren George Gore elektrolyse av tørr flussyre og lyktes i å isolere en liten mengde fluorgass. Imidlertid skjedde en eksplosjon da hydrogen og fluor kombineres voldsomt. Gore tilskrev eksplosjonen en oksygenlekkasje..
I 1886 lyktes den franske kjemikeren Henri Moisson med å isolere fluor for første gang. Tidligere ble Moissons arbeid avbrutt fire ganger av alvorlig hydrogenfluoridforgiftning, mens man forsøkte å isolere elementet..
Moisson var student av Frémy og stolte på eksperimentene sine for å isolere fluor. Moisson brukte en blanding av kaliumfluorid og flussyre i elektrolysen. Den resulterende løsningen ledet elektrisitet og fluorgass samlet ved anoden; det vil si ved den positivt ladede elektroden.
Moisson brukte korrosjonsbestandig utstyr der elektrodene var laget av en legering av platina og iridium. I elektrolysen brukte han en platinabeholder og avkjølte elektrolyttløsningen til en temperatur på -23 ºF (-31 ºC)..
Til slutt, 26. juni 1886, lyktes Henri Moissson med å isolere fluor, et arbeid som tillot ham å vinne Nobelprisen i 1906.
Interesse for fluor
Interessen for fluorforskning gikk tapt en periode. Imidlertid økte utviklingen av Manhattan-prosjektet for produksjon av atombomben det igjen.
Det amerikanske selskapet Dupont utviklet mellom årene 1930 og 1940 fluorerte produkter som klorfluorkarboner (Freon-12), brukt som kjølemedier; og polytetrafluoretylenplast, bedre kjent under navnet Teflon. Dette ga en økning i produksjonen og forbruket av fluor..
I 1986 presenterte den amerikanske kjemikeren Karl O. Christe en kjemisk metode for fremstilling av fluor ved reaksjonen mellom K på en konferanse rundt hundre år fra isoleringen av fluor.toMnF6 og SbF5.
Fysiske og kjemiske egenskaper
Utseende
Fluor er en lysegul gass. I flytende tilstand er den lysegul. I mellomtiden kan det faste stoffet være ugjennomsiktig (alfa) eller gjennomsiktig (beta).
Atomnummer (Z)
9.
Atomvekt
18.998 u.
Smeltepunkt
-219,67 ºC.
Kokepunkt
-188.11 ºC.
Tetthet
Ved romtemperatur: 1.696 g / L.
Ved smeltepunkt (væske): 1,505 g / ml.
Fordampningsvarme
6,51 kJ / mol.
Molar varmekapasitet
31 J / (mol K).
Damptrykk
Ved en temperatur på 58 K har den et damptrykk på 986,92 atm.
Termisk ledningsevne
0,0277 W / (m K)
Magnetisk rekkefølge
Diamagnetisk
Lukt
Karakteristisk skarp og skarp lukt, detekterbar selv ved 20 ppb.
Oksidasjonsnumre
-1, som tilsvarer fluoranionet, F-.
Ioniseringsenergi
-Først: 1 681 kJ / mol
-Andre: 3.374 kJ / mol
-Tredje: 6.147 KJ / mol
Elektronegativitet
3,98 på Pauling-skalaen.
Det er det kjemiske elementet med høyest elektronegativitet; det vil si at den har høy affinitet for elektronene til atomene den binder seg med. På grunn av dette genererer fluoratomer store dipolmomenter i spesifikke regioner i et molekyl..
Dens elektronegativitet har også en annen effekt: atomene bundet til den mister så mye elektrontetthet at de begynner å få en positiv ladning; dette er et positivt oksidasjonsnummer. Jo flere fluoratomer det er i en forbindelse, vil det sentrale atomet ha et mer positivt oksidasjonsnummer..
For eksempel i OFto oksygen har et oksidasjonsnummer på +2 (Oto+Fto-); i UF6, Uran har et oksidasjonsnummer på +6 (U6+F6-); det samme skjer med svovel i SF6 (S6+F6-); og endelig er det AgFto, hvor sølv til og med har et oksidasjonsnummer på +2, sjelden for det.
Derfor klarer elementene å delta med sitt mest positive oksidasjonsnummer når de danner forbindelser med fluor..
Oksidasjonsmiddel
Fluor er det kraftigste oksiderende elementet, så ingen stoffer er i stand til å oksidere det; og av denne grunn er det ikke funnet gratis i naturen.
Reaktivitet
Fluor er i stand til å kombinere med alle andre elementer unntatt helium, neon og argon. Det angriper heller ikke mildt stål eller kobber ved normale temperaturer. Reagerer voldsomt med organiske materialer som gummi, tre og stoff.
Fluor kan reagere med edelgassen xenon for å danne den sterke oksidanten xenondifluorid, XeFto. Det reagerer også med hydrogen for å danne et halogenid, hydrogenfluorid, HF. I sin tur oppløses hydrogenfluorid i vann for å produsere den berømte fluorsyren (som glass).
Surheten til sure syrer, klassifisert i økende rekkefølge, er:
HF < HCl < HBr < HI
Salpetersyre reagerer med fluor for å danne fluornitrat, FNO3. I mellomtiden reagerer saltsyre kraftig med fluor for å danne HF, OFto og ClF3.
Struktur og elektronisk konfigurasjon

Diatomisk molekyl

Fluoratomet i grunntilstand har syv valenselektroner, som er i 2s og 2p orbitaler i henhold til den elektroniske konfigurasjonen:
[Han] 2sto 2 s5
Valensbindingsteorien (VTE) sier at to fluoratomer, F, er kovalent bundet til hver fullfører valensoktet.
Dette skjer raskt fordi det bare tar ett elektron å bli isoelektronisk til neongedgassen; og dets atomer er veldig små, med en veldig sterk, kjernefysisk ladning som lett krever elektroner fra omgivelsene.
Molekylet Fto (toppbilde), har en enkelt kovalent binding, F-F. Til tross for stabiliteten sammenlignet med frie F-atomer, er det et svært reaktivt molekyl; homonukleær, apolar og ivrig etter elektroner. Det er derfor fluor, som Fto, det er en veldig giftig og farlig art.
Fordi Fto er apolar, interaksjonen avhenger av dens molekylære masse og Londons spredningskrefter. På et eller annet tidspunkt må den elektroniske skyen rundt begge F-atomer deformeres og stamme fra en øyeblikkelig dipol som induserer en annen i et nærliggende molekyl; slik at de tiltrekker seg hverandre sakte og svakt.
Flytende og fast
Molekylet Fto den er veldig liten og diffunderer relativt raskt i rommet. I sin gassfase har den en lysegul farge (som kan forveksles med en limegrønn). Når temperaturen synker til -188 ºC, blir dispersjonskreftene mer effektive og gjør F-molekyleneto samles nok til å definere en væske.
Flytende fluor (første bilde) ser enda mer gul ut enn den respektive gassen. I den er molekylene Fto de er nærmere og samhandler med lys i større grad. Interessant er at når den forvrengte kubiske fluorkrystallet dannes ved -220 ° C, blekner fargen og forblir som et gjennomsiktig fast stoff..
Nå som F-molekyleneto er så nær (men uten at molekylære rotasjoner stopper), ser det ut til at elektronene deres får en viss stabilitet, og derfor er deres elektroniske hopp for stort til at lyset til og med kan samhandle med krystallet.
Krystallinske faser
Denne kubiske krystall tilsvarer β-fasen (den er ikke en allotrop fordi den fremdeles er den samme Fto). Når temperaturen synker ytterligere, ned til -228 ºC, gjennomgår det faste fluor en faseovergang; den kubiske krystall blir en monoklinisk, α-fasen:
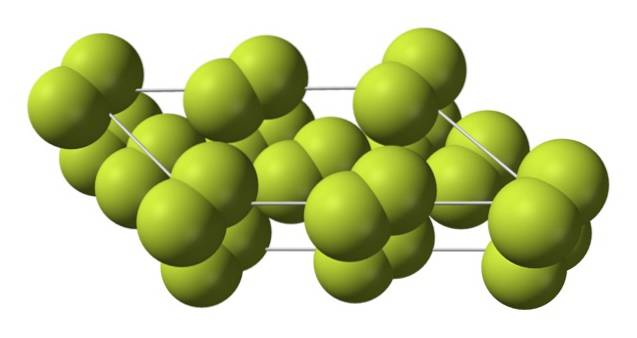
I motsetning til β-Fto, a-Fto den er ugjennomsiktig og vanskelig. Kanskje det er fordi F-molekyleneto de har ikke lenger så mye frihet til å rotere i sine faste posisjoner på monokliniske krystaller; hvor de samhandler i større grad med lys, men uten å spenne elektronene deres (som overfladisk ville forklare opasiteten deres).
Krystallstrukturen til α-Fto det var vanskelig å studere ved konvensjonelle røntgendiffraksjonsmetoder. Dette er fordi overgangen fra β til α-fasen er svært eksoterm; så krystallet eksploderte praktisk talt, samtidig som det hadde liten interaksjon med stråling.
Det tok omtrent femti år før tyske forskere (Florian Kraus et al.) Fullstendig dechiffrerte strukturen til α-Fto mer presist takket være nøytrondiffraksjonsteknikker.
Hvor å finne og skaffe
Fluor er på 24. plass blant de vanligste elementene i universet. Imidlertid er det masse 13 på jordenvo element, med en konsentrasjon på 950 ppm i jordskorpen, og en konsentrasjon på 1,3 ppm i sjøvann.
Jord har en fluorkonsentrasjon mellom 150 og 400 ppm, og i noen jorder kan konsentrasjonen nå 1000 ppm. I atmosfærisk luft er den til stede i en konsentrasjon på 0,6 ppb; men det er registrert i noen byer opp til 50 ppb.
Fluor oppnås hovedsakelig fra tre mineraler: fluoritt eller fluorospar (CaFto), fluorapatitt [Ca5(PO4)3F] og kryolitt (Na3AlF6).
Fluorittbehandling
Etter å ha samlet bergarter med mineralet fluoritt, blir de utsatt for en primær og sekundær knusing. Ved sekundær knusing oppnås veldig små steinfragmenter.
Bergfragmentene blir deretter ført til en kulkvern for reduksjon til pulver. Vann og reagenser tilsettes for å danne en pasta som plasseres i en flotasjonstank. Luft injiseres under trykk for å danne bobler, og dermed havner fluoritten i å flyte på den vandige overflaten.
Silikater og karbonater legger seg mens fluoritt samles opp og føres til tørkeovner..
Når fluoritten er oppnådd, reageres den med svovelsyre for å produsere hydrogenfluorid:
CaFto + HtoSW4 => 2 HF + CaSO4
Elektrolyse av hydrogenfluorid
Ved produksjon av fluor følges metoden som ble brukt av Moisson i 1886, med noen modifikasjoner..
En elektrolyse er laget av en blanding av smeltet kaliumfluorid og flussyre, med et molforhold på 1: 2,0 til 1: 2,2. Temperaturen på det smeltede saltet er 70 - 130 ºC.
Katoden består av en Monel-legering eller stål, og anoden er degrafitt karbon. Fluorproduksjonsprosessen under elektrolyse kan skisseres som følger:
2HF => Hto + Fto
Vann brukes til å avkjøle elektrolysekammeret, men temperaturen må være over elektrolyttens smeltepunkt for å unngå størkning. Hydrogen produsert i elektrolyse samles opp ved katoden, mens fluor ved anoden.
Isotoper
Fluor har 18 isotoper 19F den eneste stabile isotopen med 100% overflod. De 18F har en halveringstid på 109,77 minutter og er den radioaktive isotopen av fluor med den lengste halveringstiden. De 18F brukes som en kilde til positroner.
Biologisk rolle
Det er ingen kjent metabolsk aktivitet av fluor i pattedyr eller høyere planter. Noen planter og marine svamper syntetiserer imidlertid monofluoracetat, en giftig forbindelse, som de bruker som en beskyttelse for å forhindre ødeleggelse av den..
Risiko
Overdreven inntak av fluor har vært assosiert med beinfluorose hos voksne og tannfluorose hos barn, samt endringer i nyrefunksjonen. Av den grunn foreslo USAs offentlige helsetjeneste (PHS) at fluorkonsentrasjonen i drikkevann ikke skulle være større enn 0,7 mg / L.
I mellomtiden etablerte The US Enviromental Protection Agency (EPA) at konsentrasjonen av fluor i drikkevann ikke skulle være større enn 4 mg / l, for å unngå skjelettfluorose, der fluor akkumuleres i beinene. Dette kan føre til svekkelse av bein og brudd..
Fluor har vært assosiert med skade på biskjoldbruskkjertelen, med en reduksjon i kalsium i beinstrukturer og høye konsentrasjoner av kalsium i plasma.
Blant endringene som tilskrives overflødig fluor er følgende: tannfluorose, skjelettfluorose og skade på biskjoldbruskkjertelen.
Tannfluorose
Tannfluorose oppstår med små striper eller flekker i tannemaljen. Barn under 6 år bør ikke bruke munnvann som inneholder fluor..
Skjelettfluorose
Ved skjelettfluorose kan smerter og skade på bein, så vel som ledd, diagnostiseres. Benet kan stivne og miste elastisitet, noe som øker risikoen for brudd.
applikasjoner
Tannkrem

Vi begynner med delen om bruk av fluor med den mest kjente: den som fungerer som en komponent i mange tannkremer. Dette er ikke den eneste bruken der kontrasten mellom F-molekylet blir verdsattto, ekstremt giftig og farlig, og anionen F-, som avhengig av miljøet ditt kan være gunstig (men noen ganger ikke).
Når vi spiser mat, spesielt søtsaker, bryter bakterier den ned ved å øke surheten i spyttet vårt. Så kommer det et punkt der pH er sur nok til å nedbryte og demineralisere tannemaljen; hydroksyapatitt brytes ned.
Imidlertid vil ionene F i denne prosessen- samhandle med Cato+ å danne en fluorapatittmatrise; mer stabil og holdbar enn hydroksyapatitt. Eller i det minste er dette den foreslåtte mekanismen for å forklare virkningen av fluoranion på tennene. Det vil sannsynligvis være mer komplekst og ha en pH-avhengig hydroksyapatitt-fluorapatittbalanse.
Disse anionene F- De er tilgjengelige i tannplanter i form av salter; slik som: NaF, SnFto (det berømte tinnfluoridet) og NaPOF. Konsentrasjonen av F- Det må være lavt (mindre enn 0,2%), da det ellers forårsaker negative effekter på kroppen.
Fluorisering av vann
I likhet med tannkrem, har fluorsalter blitt tilsatt drikkevannskilder for å bekjempe hulrom hos de som drikker det. Konsentrasjonen bør fortsatt være mye lavere (0,7 ppm). Imidlertid er denne praksisen ofte gjenstand for mistillit og kontrovers, da den har blitt tilskrevet mulige kreftfremkallende effekter.
Oksidasjonsmiddel
Gass Fto den oppfører seg som et veldig sterkt oksidasjonsmiddel. Dette fører til at mange forbindelser brenner raskere enn når de utsettes for oksygen og en varmekilde. Det er derfor det har blitt brukt i rakettdrivstoffblandinger, der det til og med kan erstatte ozon.
Polymerer
I mange bruksområder skyldes ikke bidragene av fluor Fto eller F-, men direkte til dets elektronegative atomer som en del av en organisk forbindelse. I hovedsak snakker vi om en CF-lenke..
Avhengig av strukturen, er polymerer eller fibre med C-F-bindinger vanligvis hydrofobe, slik at de ikke blir våte eller motstår angrepet av flussyre; Eller enda bedre, de kan være utmerkede elektriske isolatorer og nyttige materialer som gjenstander som rør og pakninger er laget av. Teflon og nafion er eksempler på disse fluorerte polymerene.
Farmasøyter
Reaktiviteten til fluor gjør det brukbart for syntesen av flere fluorforbindelser, organiske eller uorganiske, tvilsomme. I organiske stoffer, spesielt de med farmakologiske effekter, erstatter en av deres heteroatomer med F-atomer (positivt eller negativt) deres virkning på deres biologiske mål..
Det er derfor i farmasøytisk industri alltid modifisering av noen legemidler ved å tilsette fluoratomer ligger på bordet..
Svært likt skjer med ugressmidler og soppdrepende midler. Fluoridet i dem kan øke deres virkning og effektivitet på insekter og soppdyr..
Glassgravering
Fluorsyre, på grunn av sin aggressivitet med glass og keramikk, har blitt brukt til å gravere tynne og delikate biter av disse materialene; vanligvis beregnet for produksjon av mikrokomponenter av datamaskiner, eller for elektriske pærer.
Uranberikelse
En av de mest relevante bruksområdene med elementært fluor er å bidra til å berike uran som 235U. For dette blir uranmineraler oppløst i flussyre og produserer UF4. Dette uorganiske fluoridet reagerer deretter med Fto, å dermed forvandle seg til UF6 (235PUH6 Y 238PUH6).
Deretter, og ved gass sentrifugering, ble 235PUH6 skiller seg fra 238PUH6 for senere å bli oksidert og lagret som kjernefysisk drivstoff.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Krämer Katrina. (2019). Frossen fluorstruktur ble gjenopptatt etter 50 år. The Royal Society of Chemistry. Gjenopprettet fra: chemistryworld.com
- Wikipedia. (2019). Fluor. Gjenopprettet fra: en.wikipedia.org
- Nasjonalt senter for bioteknologisk informasjon. (2019). Fluor. PubChem-database. CID = 24524. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Fakta om fluorelementer. Chemicool. Gjenopprettet fra: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21. februar). Den overraskende vanlige bruken av svært reaktivt fluor. Gjenopprettet fra: sciencestruck.com
- Paola Opazo Sáez. (4. februar 2019). Fluor i tannkrem: er det bra eller helsemessig? Gjenopprettet fra: nacionfarma.com
- Karl Christe & Stefan Schneider. (8. mai 2019). Fluor: kjemisk element. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- Lenntech B.V. (2019). Periodisk system: oksygen. Gjenopprettet fra: lenntech.com
- Gagnon Steve. (s.f.). Elementet fluor. Jefferson Lab. Gjenopprettet fra: education.jlab.org
- American Cancer Society medisinsk og redaksjonelt innholdsteam. (2015, 28. juli). Vannfluorisering og kreftrisiko. Gjenopprettet fra: cancer.org



Ingen har kommentert denne artikkelen ennå.