
Aluminiumfosfid (AIP) struktur, egenskaper, bruksområder, risiko
De aluminiumfosfid Det er en uorganisk forbindelse dannet av et aluminiumatom (Al) og et fosforatom (P). Den kjemiske formelen er AlP. Det er en solid mørk grå eller, hvis veldig ren, gul. Det er en ekstremt giftig forbindelse for levende vesener.
Aluminiumfosfid reagerer med fuktighet og danner fosfin eller fosfan PH3, som er en giftig gass. Av denne grunn må AlP ikke komme i kontakt med vann. Reagerer sterkt med syrer og alkaliske oppløsninger.

Det ble brukt tidligere for å eliminere skadedyr som insekter og gnagere på steder der korn og andre landbruksprodukter ble lagret. På grunn av den høye faren har det imidlertid blitt forbudt i de fleste land i verden..
For tiden undersøkes dets nytteverdi i elektronikkområdet teoretisk ved hjelp av datamaskiner som beregner muligheten for å skaffe halvleder-AlP-nanorør, det vil si ekstremt små rør som bare kan overføre strøm under visse forhold..
Aluminiumfosfid er en veldig farlig forbindelse. Den må håndteres med sikkerhetsredskaper som hansker, briller, åndedrettsvern og verneutstyr..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Tetthet
- 3.5 Løselighet
- 3.6 Kjemiske egenskaper
- 3.7 Andre egenskaper
- 4 Motta
- 5 bruksområder
- 5.1 Ved eliminering av skadedyr (avbrutt bruk)
- 5.2 I andre applikasjoner
- 6 Teoretisk undersøkelse av AlP-nanorør
- 6.1 AlP-nanorør med bor
- 6.2 AlP-nanorør med endret struktur
- 7 Risiko
- 8 Referanser
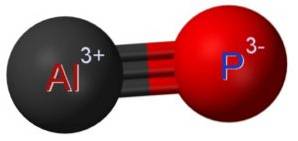
Struktur
Aluminiumfosfidet AlP dannes ved foreningen av et aluminiumatom Al og et fosforatom P. Bindingen mellom begge er kovalent og trippel, derfor er den veldig sterk.
Aluminium i AlP har en oksidasjonstilstand på +3 og fosfor har en valens på -3.
Nomenklatur
- Aluminiumfosfid
Eiendommer
Fysisk tilstand
Mørkegrått eller mørkegult eller grønt krystallinsk fast stoff. Kubiske krystaller.
Molekylær vekt
57,9553 g / mol
Smeltepunkt
2550 ºC
Tetthet
2,40 g / cm3 ved 25 ° C
Løselighet
Nedbrytes i vann.
Kjemiske egenskaper
Reagerer med fuktighet for å gi fosfin eller fosfan PH3 som er en brennbar og giftig forbindelse. Fosfin eller fosfat antennes spontant ved kontakt med luft, bortsett fra hvis det er overflødig vann.
Reaksjonen av aluminiumfosfid med vann er som følger:
Aluminiumfosfid + vann → Aluminiumhydroksid + fosfin
AlP + 3 HtoO → Al (OH)3 + PH3↑
De kommersielle presentasjonene har aluminiumkarbonat Alto(CO3)3 for å forhindre fosfin selvantennelse som oppstår når AlP kommer i kontakt med fuktighet i luften.
AlP er stabil når den er tørr. Reagerer voldsomt med syrer og alkaliske løsninger.
Aluminiumfosfid AlP smelter ikke, sublimerer eller nedbrytes ikke termisk ved temperaturer så høyt som 1000 ° C. Selv ved denne temperaturen er damptrykket veldig lavt, det vil si at det ikke fordamper ved den temperaturen..
Ved oppvarming til nedbrytning avgir den giftige fosforoksider. I kontakt med metaller kan den avgi brennbare hydrogengasser Hto.
Andre egenskaper
Når den er ren, viser den en gulaktig farge, når den blandes med rester av prepareringsreaksjonen, gir den en farge fra grå til svart..
Den lave flyktigheten utelukker at den lukter, så hvitløkslukten som den noen ganger avgir, skyldes fosfin PH3 som dannes i nærvær av fuktighet.
Å skaffe
Aluminiumfosfid kan oppnås ved å varme opp en blanding av pulverisert aluminiummetall (Al) og det røde fosfor (P) -elementet.
På grunn av affiniteten til fosfor (P) for oksygen (Oto) og aluminium (Al) med oksygen og nitrogen (Nto), må reaksjonen utføres i en atmosfære fri for disse gassene, for eksempel i en atmosfære av hydrogen (Hto) eller naturgass.
Reaksjonen startes ved hurtig oppvarming av en sone av blandingen til reaksjonen starter, som er eksoterm (varme produseres under reaksjonen). Fra det øyeblikket går reaksjonen raskt.
Aluminium + fosfor → Aluminiumfosfid
4 Al + P4 → 4 AlP
applikasjoner
Eliminering av skadedyr (avbrutt bruk)
Aluminiumfosfid ble tidligere brukt som insektmiddel og som gnagerdrepende. Imidlertid, selv om det har blitt utestengt på grunn av toksisitet, brukes det fortsatt i noen deler av verden..
Den brukes til røyking i lukkede rom der det er bearbeidede eller ubehandlede landbruksmatvarer (som korn), dyrefôr og ikke-matvarer.
Målet er å kontrollere insekter og gnagere som angriper lagrede gjenstander, enten de er spiselige eller ikke..
Det gjør det mulig å kontrollere gnagere og insekter i ikke-husholdnings-, landbruks- eller ikke-jordbruksområder, sprøyting utendørs eller i hulene og reirene for å forhindre at de overfører visse sykdommer.


Dens bruksform består i å utsette AlP for luft eller fuktighet, siden fosfin eller fosfan PH frigjøres.3 som skader mange organer i skadedyret som skal elimineres.

I andre applikasjoner
Aluminiumfosfid AlP brukes som kilde til fosfin eller fosfan PH3 og blir brukt i halvlederforskning.
Teoretisk undersøkelse av AlP-nanorør
Teoretiske studier har blitt utført på dannelsen av aluminiumfosfid AlP nanorør. Nanorør er veldig små og veldig tynne sylindere som bare kan vises med et elektronmikroskop..
AlP nanorør med bor
Teoretiske studier utført gjennom beregningsberegninger viser at urenheter som kan tilsettes AlP-nanorørene kan endre de teoretiske egenskapene til disse.
For eksempel anslås det at tilsetning av bor (B) -atomer til AlP-nanorør kan gjøre dem til halvledertype-s. En halvleder er et materiale som oppfører seg som en leder av elektrisitet eller som en isolator avhengig av det elektriske feltet det utsettes for.
Og en halvledertype-s Dette er når urenheter tilsettes materialet, i dette tilfellet er AlP utgangsmaterialet og boratomer vil være urenheter. Halvledere er nyttige for elektronikkapplikasjoner.
AlP nanorør med endret struktur
Noen forskere har utført beregninger for å bestemme effekten av å endre krystallgitterstrukturen til AlP-nanorør fra sekskantet til oktaedrisk..
De fant at manipulering av gitterstrukturen kunne brukes til å finjustere ledningsevnen og reaktiviteten til AlP-nanorør og designe dem for å være nyttige for elektronikk- og optikkapplikasjoner..
Risiko
Kontakt med aluminiumfosfid kan irritere hud, øyne og slimhinner. Ved svelging eller innånding er det giftig. Kan absorberes gjennom huden med giftige effekter.
Hvis AlP kommer i kontakt med vann, reagerer det og danner fosfin eller fosfat PH3 som er ekstremt brannfarlig da den antennes i kontakt med luft. Derfor kan det eksplodere. I tillegg fører fosfin til at mennesker og dyr dør.
Siden aluminiumfosfid er et billig plantevernmiddel, er det en vanlig årsak til forgiftning hos mennesker og har en høy dødelighet..

Den reagerer med fuktigheten i slimhinnene og med saltsyren HCl i magen og danner den meget giftige fosfangassen PH3. Derfor, ved innånding og ved svelging, dannes fosfin i kroppen med dødelige effekter..
Inntaket forårsaker blødning i mage-tarmkanalen, kardiovaskulær kollaps, nevropsykiatriske lidelser, luftveis- og nyresvikt i løpet av få timer..
AlP er veldig giftig for alle landdyr og vanndyr.
Referanser
- OSS. National Library of Medicine. (2019). Aluminiumfosfid. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Sjögren, B. et al. (2007). Aluminium. Andre aluminiumforbindelser. I Handbook on the Toxicology of Metals (Tredje utgave). Gjenopprettet fra sciencedirect.com.
- Gupta, R.C. og Crissman, J.W. (2013). Sikkerhetsvurdering inkludert aktuelle og nye spørsmål i toksikologisk patologi. Menneskelig risiko. I Haschek og Rousseauxs håndbok for toksikologi patologi (tredje utgave). Gjenopprettet fra sciencedirect.com.
- White, W.E. og Bushey, A.H. (1944). Aluminiumfosfid - Klargjøring og sammensetning. Journal of The American Chemical Society 1944, 66, 10, 1666-1672. Gjenopprettet fra pubs.acs.org.
- Mirzaei, Maryam og Mirzaei, Mahmoud. (2011). En teoretisk studie av bor-dopet aluminiumfosfid-nanorør. Beregnings- og teoretisk kjemi 963 (2011) 294-297. Gjenopprettet fra sciencedirect.com.
- Takahashi, L. og Takahashi, K. (2018). Tuning av den elektroniske strukturen til en aluminiumfosfid nanorør gjennom konfigurering av gittergeometrien. ACS Appl. Nano Mater. 2018, 1, 501-504. Gjenopprettet fra pubs.acs.org.
- Gupta, P.K. (2016). Giftige effekter av plantevernmidler (agrokjemikalier). Aluminiumfosfid. I Fundamentals of Toxicology. Gjenopprettet fra sciencedirect.com.



Ingen har kommentert denne artikkelen ennå.