
Helium historie, egenskaper, struktur, risiko, bruksområder
De helium er et kjemisk element hvis symbol er Han. Det er den første edelgassen i det periodiske systemet, og den ligger vanligvis ytterst til høyre for den. Under normale forhold er det en inert gass, siden ingen av dens få forbindelser er stabile; Det utvides også veldig raskt og er stoffet med det laveste kokepunktet av alle.
På et populært nivå er det en kjent gass, siden det i utallige arrangementer eller barnefester er vanlig å være vitne til hvordan en ballong stiger til den går tapt på himmelen. Imidlertid, det som virkelig og for alltid er tapt i hjørnene av solsystemet og utover, er heliumatomene som frigjøres når ballongen eksploderer eller tømmes..

Faktisk er det de som, og med god grunn, anser at heliumballonger representerer en upassende praksis for denne gassen. Heldigvis har den viktigere og mer interessante bruksområder, takket være dens fysiske og kjemiske egenskaper som skiller den fra andre kjemiske elementer..
For eksempel er flytende helium så kaldt at det kan fryse hva som helst, som en metalllegering, og gjør det til et superledende materiale. På samme måte er det en væske som manifesterer overflødighet, i stand til å klatre opp veggene i en glassbeholder..
Navnet skyldes at det ble identifisert for første gang på solen og ikke på jorden. Det er det nest mest utbredte elementet i hele universet, og selv om dets konsentrasjon er ubetydelig i jordskorpen, kan den hentes fra reservene av naturgass og radioaktive mineraler av uran og thorium..
Her demonstrerer helium et annet merkelig faktum: det er en gass som er mye rikere i undergrunnen enn i atmosfæren, der den ender med å rømme fra jorden og dens gravitasjonsfelt.
Artikkelindeks
- 1 Historie
- 2 Fysiske og kjemiske egenskaper
- 2.1 Utseende
- 2.2 Atomnummer (Z)
- 2.3 Molar masse
- 2.4 Smeltepunkt
- 2.5 Kokepunkt
- 2.6 Tetthet
- 2.7 Trippelpunkt
- 2.8 Kritisk poeng
- 2.9 Fusjonsvarme
- 2.10 Fordampningsvarme
- 2.11 Molar varmekapasitet
- 2.12 Damptrykk
- 2.13 Ioniseringsenergier
- 2.14 Løselighet
- 2.15 Reaktivitet
- 2.16 oksidasjonsnummer
- 3 Struktur og elektronisk konfigurasjon
- 3.1 Dimere
- 3.2 Helium II
- 3.3 Krystaller
- 4 Hvor å finne og skaffe
- 4.1 Kosmos og bergarter
- 4.2 Luft og hav
- 4.3 Kondensering og destillasjon av naturgass
- 5 isotoper
- 6 Risiko
- 7 bruksområder
- 7.1 Trykk- og blødningssystemer
- 7.2 Lekkasjedeteksjoner
- 7.3 Transportgass
- 7.4 Ballonger og blimps
- 7.5 Dykking
- 7.6 Buesveis
- 7.7 Superledere
- 8 Referanser
Historie
Helium ble ikke oppdaget på jorden, men på solen. Navnet kommer faktisk fra det greske ordet "helios" som betyr sol. Eksistensen av elementet i seg selv kontraste det periodiske systemet til Dmitri Mendeleev, siden det ikke var plass i det for en ny gass; det er, da var absolutt ingenting mistenkt om edelgasser.
Navnet 'helium', skrevet som 'helium' på engelsk, endte med at suffikset -ium refererte til det som et metall; nettopp fordi eksistensen av en annen gass enn oksygen, hydrogen, fluor, klor og nitrogen ikke kunne tillates.
Dette navnet ble utpekt av den engelske astronomen Norman Lockyer, som studerte fra England hva som ble observert av den franske astronomen Jules Janssen i India, under en solformørkelse i 1868.
Det var en gul spektral linje av et hittil ukjent element. Lockyer hevdet at dette skyldtes tilstedeværelsen av et nytt kjemisk element som ble funnet i solen.
I 1895, nesten tjue år senere, anerkjente den skotske kjemikeren Sir William Ramsay det samme spekteret fra en restgass da han studerte et radioaktivt mineral: cleveitt. Så det var helium her også på jorden.
Fysiske og kjemiske egenskaper
Utseende
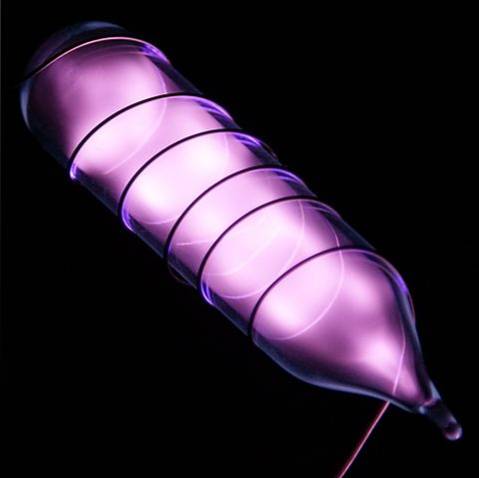
Helium er en fargeløs, luktfri gass som ikke har smak og er også inert. Imidlertid, når et elektrisk støt påføres, og avhengig av spenningsforskjellen, begynner det å lyse som en grå-lilla tåke (bildet over), og deretter lyse med en oransje glød. Derfor er heliumlysene oransje.
Atomnummer (Z)
to
Molarmasse
4,002 g / mol
Smeltepunkt
-272,2 ºC
Kokepunkt
-268,92 ºC
Tetthet
-0,1786 g / l, under normale forhold, det vil si i gassfasen.
-0,155 g / ml, ved smeltepunkt, flytende helium.
-0,125 g / ml, akkurat som helium begynner å koke.
-0,187 g / ml, ved 0 K og 25 atm, det vil si solid helium ved de spesifikke trykk- og temperaturforholdene.
Trippel punkt
2177 K og 5043 kPa (0,04935 atm)
Kritisk punkt
5.1953 K og 0.22746 MPa (2.2448 atm)
Fusjonsvarme
0,0138 kJ / mol
Fordampningsvarme
0,0829 kJ / mol
Molar varmekapasitet
20,78 J / (mol K)
Damptrykk
0.9869 atm ved 4.21 K. Denne verdien gir deg en ide om hvor flyktig helium kan være og hvor lett det kan slippe ut ved romtemperatur (nær 298 K).
Ioniseringsenergier
-Først: 2372,3 kJ / mol (He+ gassformig)
-Andre: 5250,5 kJ / mol (Heto+ gassformig)
Ioniseringsenergiene for helium er spesielt høye fordi gassatomet må miste et elektron, som opplever en sterk effektiv kjernefysisk ladning. Det kan også forstås ved å vurdere den lille størrelsen på atomet og hvor "nær" de to elektronene er til kjernen (med sine to protoner og to nøytroner).
Løselighet
I vann oppløses 0,97 ml for hver 100 ml vann ved 0 ºC, noe som betyr at det er dårlig løselig.
Reaktivitet
Helium er det nest minst reaktive kjemiske elementet i naturen. Under normale forhold er det riktig å si at det er en inert gass; Aldri (ser det ut til) kan en heliumforbindelse manipuleres i et rom eller laboratorium uten at et enormt trykk virker på det; eller kanskje dramatisk høye eller lave temperaturer.
Et eksempel vi ser i forbindelsen NatoHan, som bare er stabil under et trykk på 300 GPa, reprodusert i en diamantamboltcelle.
Mens de kjemiske bindingene i NatoDe er "rare" når de har elektronene godt plassert i krystallene, de er langt fra enkle Van der Walls-interaksjoner, og derfor består de ikke bare av heliumatomer fanget av molekylære aggregater. Det er her dilemmaet oppstår mellom hvilke heliumforbindelser som er virkelige og hvilke som ikke er det..
For eksempel kan nitrogenmolekyler ved høyt trykk fange et heliumatom til å danne en slags klatrat, He (Nto)elleve.
Likeledes er det endohedrale komplekser av fullerenkationer, C60+n og C70+n, i hvis hulrom de kan romme heliumatomer; og det molekylære kationen HeH+ (He-H+), funnet i svært fjerne tåker.
Oksidasjonsnummer
Hvem av nysgjerrighet prøver å beregne oksidasjonsnummeret for helium i noen av forbindelsene, vil finne at dette er lik 0. I NatoHan kan for eksempel tenkes at formelen tilsvarer hypotetiske Na-ionerto+jeg harto-; men slik ville være å anta at den har en ren ionisk karakter, når dens bånd i virkeligheten er langt fra å være slik.
Videre får ikke helium elektroner fordi det ikke kan ta imot dem i 2s orbital, energisk utilgjengelig; Det er heller ikke mulig for det å miste dem på grunn av atomets lille størrelse og kjernens store effektive kjerneladning. Derfor deltar helium alltid (i teorien) som et atom He0 i dets avledede forbindelser.
Struktur og elektronisk konfigurasjon
Helium, som alle gasser som observeres i makroskala, opptar volumet av beholderne som lagrer det, og har dermed en ubestemt form. Imidlertid, når temperaturen synker og begynner å avkjøles under -269 ºC, kondenserer gassen til en fargeløs væske; helium I, den første av de to væskefasene for dette elementet.
Årsaken til at helium kondenserer ved så lav temperatur, skyldes de lave spredningskreftene som holder atomene sammen; uansett hvilken fase det ble vurdert. Dette kan forklares fra den elektroniske konfigurasjonen:
1sto
I hvilke to elektroner okkuperer 1s atombane. Heliumatomet kan visualiseres som en nesten perfekt sfære, hvis homogene elektroniske periferi er lite utsatt for polarisering av den effektive kjerneladningen til de to protonene i kjernen..
Dermed er spontane og induserte dipolmomenter sjeldne og veldig svake; så temperaturen må nærme seg absolutt null slik at He-atomene nærmer seg sakte nok og oppnår at deres spredningskrefter definerer en væske; eller enda bedre, en heliumkrystall.
Dimers
I gassfasen er rommet som skiller He-atomene slik at det kan antas at de alltid er atskilt fra hverandre. Så mye at i et hetteglass med lite volum, ser helium ut fargeløst til det utsettes for en elektrisk utladning, som ioniserer atomene i en gråaktig og ikke veldig lys tåke..
Imidlertid, i den flytende fasen kan ikke Atomer, selv med deres svake interaksjoner, lenger "ignoreres". Nå lar dispersjonskraften dem øyeblikkelig gå sammen for å danne dimerer: Han-han eller hanto. Derfor kan jeg tenke på helium som store klynger av Hanto i likevekt med atomene i dampfasen.
Det er derfor helium I er så vanskelig å skille fra dampene. Hvis denne væsken søles ut av den lufttette beholderen, slipper den ut som en hvitaktig bluss..
Helium II
Når temperaturen synker enda mer, og berører 2.178 K (-270.972 ° C), skjer en faseovergang: helium I blir omgjort til helium II.
Fra dette punktet blir den allerede fascinerende heliumvæsken en superfluid eller kvantevæske; det vil si at deres makroskopiske egenskaper manifesteres som om dimerer Hanto de var individuelle atomer (og kanskje de er). Den mangler full viskositet, da det ikke er noen overflate som kan stoppe et atom under glidning eller "klatring".
Det er grunnen til at helium II kan klatre opp på veggene til en glassbeholder og overvinne tyngdekraften; uansett hvor høye de er, så lenge overflaten holder seg ved samme temperatur og derfor ikke flyktiggjøres.
På grunn av dette kan ikke flytende helium lagres i glassbeholdere, siden det vil rømme ved den minste sprekk eller gap. veldig lik hvordan det ville skje med en gass. I stedet brukes rustfritt stål til å designe slike kar (Dewars tanker).
Krystaller
Selv om temperaturen falt til 0 K (absolutt null), ville ikke spredningskraften mellom He-atomene være sterk nok til å ordne dem i en krystallinsk struktur. For at størkning skal skje, må trykket øke til omtrent 25 atm; og deretter vises kompakte sekskantede heliumkrystaller (hcp).
Geofysiske studier viser at denne hcp-strukturen forblir uendret uansett hvor mye trykk øker (opp til størrelsen på gigapascal, GPa). Imidlertid er det et smalt område i deres trykk-temperatur-diagram der disse hcp-krystallene gjennomgår en overgang til en kroppssentrert kubisk fase (bcc)..
Hvor å finne og skaffe
Kosmos og bergarter

Helium er det nest mest utbredte elementet i hele universet, nest nest etter hydrogen. Stjerner produserer stadig umåtelige mengder heliumatomer gjennom fusjonen av to hydrogenkjerner under nukleosyntese-prosessen..
Likeledes er enhver radioaktiv prosess som avgir α-partikler, en kilde til produksjon av heliumatomer hvis de samhandler med elektronene i miljøet; for eksempel med de av en steinete kropp i avleiringer av radioaktive mineraler av uran og thorium. Disse to elementene gjennomgår radioaktivt forfall, og begynner med uran:
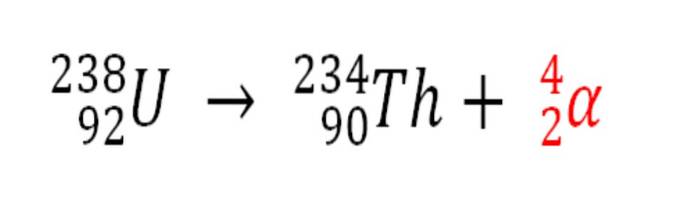
Derfor, i bergartene der disse radioaktive mineralene er konsentrert, vil heliumatomene bli fanget, som vil frigjøres når de blir fordøyd i sure medier..
Blant noen av disse mineralene er cleveitt, karnotitt og uraninitt, alle sammensatt av uranoksider (UOto eller U3ELLER8) og thorium, urenheter i tungmetall og sjeldne jordarter. Helium, vannet gjennom underjordiske kanaler, kan ende opp med å samle seg i naturgassreservoarer, mineralkilder eller i meteoriske jern.
Det anslås at det produseres en heliummasse tilsvarende 3000 tonn årlig i litosfæren, fra det radioaktive forfallet av uran og thorium..
Luft og hav
Helium er ikke veldig løselig i vann, så det snarere ender opp med å stige opp fra dypet (uansett hvor det er opprinnelse), til det krysser lagene i atmosfæren og til slutt når verdensrommet. Atomene er så små og lette at jordens gravitasjonsfelt ikke kan beholde dem i atmosfæren..
På grunn av det ovennevnte er konsentrasjonen av helium både i luften (5,2 ppm) og i havet (4 ppt) veldig lav..
Hvis vi ønsket å trekke det ut fra et av disse to mediene, ville det "beste" alternativet være luft, som først måtte utsettes for kondensering for å kondensere alle komponentgassene, mens helium forblir i en gassform..
Imidlertid er det ikke praktisk å skaffe helium fra luften, men fra bergarter beriket med radioaktive mineraler; eller enda bedre, fra naturgassreserver, hvor helium kan utgjøre opptil 7% av den totale massen.
Liquefaction og destillasjon av naturgass
I stedet for å kondensere luften, er det enklere og mer lønnsomt å bruke naturgass, hvis heliumsammensetning utvilsomt er mye større. Råmaterialet par excellence (kommersielt) for å oppnå helium er således naturgass, som også kan utsettes for fraksjonell destillasjon.
Sluttproduktet av destillasjonen avsluttes ved rensing med aktivt karbon, gjennom hvilket et veldig rent helium passerer gjennom. Og til slutt skilles helium fra neon ved en kryogen prosess der flytende helium brukes..
Isotoper
Helium forekommer hovedsakelig i naturen som isotopen 4Han, hvis bare kjerne er den berømte α-partikkelen. Dette atom av 4Han har to nøytroner og to protoner. I mindre overflod er isotopen 3Han, som bare har ett nøytron. Den første er tyngre (har en høyere atommasse) enn den andre.
Dermed isotopar 3Jeg har og 4Han er de som definerer de målbare egenskapene og hva vi forstår av helium som et kjemisk element. Siden 3Han er lettere, det antas at atomene har høyere kinetisk energi, og at de derfor trenger en enda lavere temperatur til kohesjon i en superfluid.
De 3Han regnes som en veldig sjelden art her på jorden; på månens jord er det imidlertid rikere (ca. 2000 ganger mer). Det er derfor Månen har vært gjenstand for prosjekter og historier som en mulig kilde til 3Han, som kan brukes som kjernefysisk drivstoff for fremtidens romfartøy.
Blant andre isotoper av helium kan følgende nevnes, med deres respektive halveringstider: 5Jeg har (t1/2= 7,610−22 s), 6Jeg har (t1/2= 0,8 s) og 8Jeg har (t1/2= 0,119 s).
Risiko
Helium er en inert gass og deltar derfor ikke i noen av reaksjonene som forekommer i kroppene våre..
Atomer kommer praktisk talt ut og ut pustet uten at deres interaksjoner med biomolekyler gir en påfølgende effekt; bortsett fra lyden fra stemmebåndene, som blir høyere og har høyere frekvens.
Mennesker som inhalerer helium fra en ballong (i moderasjon) snakker med en høy stemme, lik den fra en ekorn (eller and).
Problemet er at hvis han inhalerer en uhensiktsmessig mengde helium, risikerer han kvelning, siden atomene fortrenger oksygenmolekylene; og derfor vil du ikke være i stand til å puste før du puster ut alt heliumet, som igjen på grunn av trykket kan rive lungevevet eller forårsake barotrauma.
Det er rapportert om tilfeller av mennesker som har dødd av inhalasjon av helium på grunn av det som nettopp er forklart.
På den annen side, selv om det ikke representerer en brannrisiko gitt sin mangel på reaktivitet mot oksygen (eller et annet stoff), hvis det lagres under høyt trykk og det slipper ut, kan lekkasjen være fysisk farlig..
applikasjoner
Heliums fysiske og kjemiske egenskaper gjør det ikke bare til en spesiell gass, men også til et veldig nyttig stoff for applikasjoner som krever ekstremt lave temperaturer. I denne delen vil noen av disse applikasjonene eller bruken bli tatt opp..
Trykk- og blødningssystemer
I noen systemer er det nødvendig å øke trykket (under trykk), og for dette må det injiseres eller tilføres en gass som ikke samhandler med noen av komponentene; f.eks. med reagenser eller overflater som er følsomme for uønskede reaksjoner.
Dermed kan trykket økes med volumer av helium, hvis kjemiske inertitet gjør det ideelt for dette formålet. Den inerte atmosfæren som den tilrettelegger for, overstiger i visse tilfeller nitrogen.
For den omvendte prosessen, det vil si rensingen, brukes helium også på grunn av dets evne til å bære alt oksygen, vanndamp eller annen gass, hvis tilstedeværelse du vil fjerne. På denne måten reduseres trykket i systemet når heliumet er tømt..
Lekkasjedeteksjoner
Helium kan lekke gjennom den minste sprekk, så det tjener også til å oppdage lekkasjer i rør, høyt vakuumbeholdere eller kryogene tanker.
Noen ganger kan deteksjon gjøres visuelt eller ved berøring; det meste er imidlertid en detektor som "gir" signalet om hvor og hvor mye helium som rømmer fra systemet under inspeksjon..
Transportgass
Heliumatomer, som nevnt for rensesystemer, kan bære med seg tyngre molekyler, avhengig av deres trykk. For eksempel blir dette prinsippet brukt daglig i gasskromatografianalyse, siden det kan dra den forstøvede prøven langs kolonnen, hvor den interagerer med den stasjonære fasen..
Ballonger og luftskip

På grunn av den lave tettheten sammenlignet med luft og igjen, den manglende reaktiviteten med oksygen, har den blitt brukt til å blåse opp ballonger på barnefester (blandet med oksygen slik at ingen kveles fra å puste den), og luftskip (toppbilde), uten å utgjøre en fare for brann.
Dykking

Når dykkere kommer ned på større dyp, har de vanskelig for å puste på grunn av det store trykket som vannet utøver. Det er derfor helium tilsettes oksygentankene for å redusere tettheten til gassen som dykkere puster og puster ut, og dermed kan den pustes ut med mindre arbeid..
Buesveiser
I sveiseprosessen gir den elektriske lysbuen nok varme til at de to metallene kan komme sammen. Hvis det gjøres under en heliumatmosfære, vil ikke glødemetallet reagere med oksygenet i luften for å bli dets respektive oksid; derfor hindrer helium at dette skjer.
Superledere
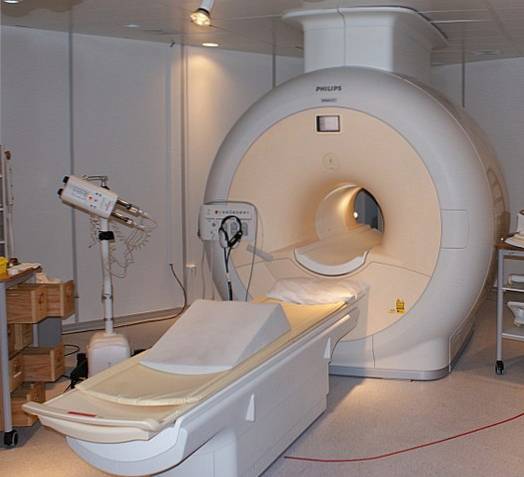
Flytende helium er så kaldt at det kan fryse metaller til superledere. Takket være dette har det vært mulig å produsere meget kraftige magneter, som, avkjølt med flytende helium, har blitt brukt i bildeskannere eller kjernemagnetiske resonansspektrometre..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Andy Extance. (17. april 2019). Heliumhydridion oppdaget i rommet for første gang: bevis funnet for unnvikende kjemi fra universets første minutter. Gjenopprettet fra: chemistryworld.com
- Peter Wothers. (19. august 2009). Helium. Kjemi i sitt element. Gjenopprettet fra: chemistryworld.com
- Wikipedia. (2019). Helium. Gjenopprettet fra: en.wikipedia.org
- Mao, H. K., Wu, Y., Jephcoat, A. P., Hemley, R. J., Bell, P. M., & Bassett, W. A. (1988). Krystallstruktur og tetthet av Helium opp til 232 Kbar. Gjenopprettet fra: articles.adsabs.harvard.edu
- Nasjonalt senter for bioteknologisk informasjon. (2019). Helium. PubChem-database. CID = 23987. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Mary-Ann Muffoletto. (6. februar 2017). Opp, opp og bort: Kjemikere sier 'ja', helium kan danne forbindelser. Utah State University. Gjenopprettet fra: phys.org
- Steve Gagnon. (s.f.). Isotoper av Element Helium. Jefferson Lab. Gjenopprettet fra: education.jlab.org
- Advameg, Inc. (2019). Helium. Gjenopprettet fra: chemistryexplained.com


Ingen har kommentert denne artikkelen ennå.