
Hexokinase strukturer, funksjoner, former

De heksokinase (HK) er enzymet som katalyserer den første reaksjonen av glykolytisk vei i praktisk talt alle levende organismer, både prokaryoter og eukaryoter. Det er ansvarlig for overføring av en fosforylgruppe til glukose, og produserer glukose-6P, selv om den også kan fosforylere andre sukkerheksoser (6 karbonatomer).
Dette enzymet er klassifisert i en av de to familiene av glukokinaseenzymer (enzymer som overfører fosforylgrupper til substrater som glukose): heksokinase (HK) -familien, hvis medlemmer er delt inn i tre forskjellige grupper kjent som HK-gruppen, gruppen A og gruppe B.
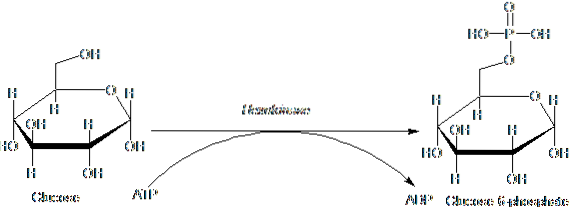
Enzymer som tilhører HK-familien er karakterisert ved fosforylerende glukose på bekostning av ATP som et fosforylgruppedonormolekyl, og dets medlemmer skiller seg hovedsakelig fra hverandre med hensyn til deres molekylvekt og substratspesifisitet..
HK-gruppen inkluderer enzymer fra eukaryote organismer (ATP: D-heksose 6-fosfotransferaser), mens gruppe A er representert av enzymer av gramnegative bakterier, cyanobakterier, amitokondriatprotister og trypanosomatider, og gruppe B inneholder enzymene gram-positive bakterier og crenoqueotiske organismer.
Gruppe A og B enzymer er også kjent som glukokinaser (GlcKs), da de utelukkende er i stand til å fosforylere glukose, og det er grunnen til at disse enzymene kalles ATP: D-glukose 6-fosfotransferaser.
Som et glykolytisk enzym har heksokinase stor metabolsk betydning, siden uten den ville denne viktige veien ikke være mulig, og celler som var svært avhengige av karbohydratforbruk, slik som hjernen og muskelcellene til mange pattedyr, ville ha alvorlige funksjonelle og fysiologiske hindringer generelt..
Artikkelindeks
- 1 Struktur
- 2 funksjoner
- 2.1 I planter
- 3 former
- 4 Referanser
Struktur
Som det vil sees senere, finnes forskjellige typer heksokinaseenzymer hos pattedyr og andre virveldyr (så vel som i encellede organismer som gjær). Hos pattedyr er fire beskrevet: isoformer I, II, III og IV.
De tre første isozymer har molekylvekt på 100 kDa, men isozym IV har 50 kDa. Disse isoenzymer (spesielt I-III) utviser høy sekvenslikhet mellom dem med hensyn til deres C- og N-terminaler, så vel som med andre medlemmer av heksokinasefamilien..
Det N-terminale domenet til disse enzymene betraktes som det "regulatoriske" domenet, mens den katalytiske aktiviteten utføres av det C-terminale domenet (pattedyr HK II har aktive seter i begge domener).
Det N-terminale domenet er koblet til det C-terminale domenet gjennom en alfa-helix, hver er omtrent 50 kDa i molekylvekt og har et bindingssted for glukose.
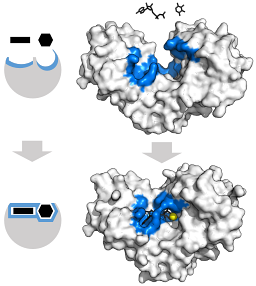
Den tertiære strukturen til disse enzymene er i det vesentlige sammensatt av p-brettede ark blandet med alfa-helixer, hvis andel varierer med hensyn til enzymet og arten i spørsmålet; bindingsstedet for ATP, det andre substratet for heksokinase, består vanligvis av fem β-ark og to alfa-helixer.
Funksjoner
Heksokinase har en transcendental funksjon i karbohydratmetabolismen til de fleste levende vesener, siden det katalyserer det første trinnet i glykolytisk vei, og formidler fosforylering av glukose inne i cellen..
Dette første trinnet av glykolyse, som består av overføring av en fosforylgruppe fra ATP (donor) til glukose, og gir glukose 6-fosfat og ADP, er det første av de to energinvesteringstrinnene i form av ATP.
Videre er reaksjonen katalysert av heksokinase trinnet "aktivering" av glukose for den etterfølgende prosessering og representerer et trinn med "forpliktelse", siden glukosen som således fosforyleres ikke kan forlate cellen ved hjelp av dens konvensjonelle transportører i membranen..
Produktet av reaksjonen katalysert av heksokinase, det vil si glukose 6-fosfat, er et forgreningspunkt, siden det er det første substratet som brukes i pentosefosfatveien og i syntesen av glykogen hos mange dyr (og stivelsen i planter).
I plantene
Funksjonen til heksokinase i planter er ikke veldig forskjellig fra dyr eller mikroorganismer, men i høyere planter fungerer dette enzymet også som en "sensor" for konsentrasjonen av sukker..
Betydningen av denne funksjonen i disse organismer har å gjøre med sukkers deltagelse som regulatoriske faktorer i uttrykket av gener som er involvert i forskjellige metabolske prosesser som:
- Fotosyntese
- Glyoksylatsyklusen
- Pusten
- Nedbrytning eller syntese av stivelse og sukrose
- Nitrogenmetabolisme
- Forsvar mot patogener
- Regulering av cellesyklusen
- Den helbredende responsen
- Pigmentering
- Senescence, blant andre.
Denne funksjonen av heksokinase som en "sensor" av mengden intracellulær glukose er også beskrevet for gjær og pattedyr..
Former
I naturen er det forskjellige former for heksokinaser, og dette avhenger fundamentalt av arten som blir vurdert.
For eksempel hos mennesker og andre virveldyr er det vist at det er fire forskjellige isoformer av heksokinase-enzymet i det cytosoliske rommet, som er betegnet med de romerske tallene I, II, III og IV.
Isoenzymer I, II og III har en molekylvekt på 100 kDa, inhiberes av reaksjonsproduktet (glukose 6-fosfat) og er veldig glukoserelaterte, det vil si at de har en veldig lav Km konstant. Imidlertid har disse enzymene dårlig substratspesifisitet og er i stand til å fosforylere andre heksoser som fruktose og mannose..
Isoenzyme IV, også kjent som glukokinase (GlcK), har bare 50 kDa i molekylvekt, og til tross for at den er dårlig relatert (høye Km-verdier), har den høy spesifisitet for glukose som substrat og er ikke utsatt for dem. de tre andre isoenzymer.
Glukokinase (isoenzym IV av heksokinase fra mange pattedyr) finnes hovedsakelig i leveren og hjelper dette organet med å "justere" glukoseforbruket som svar på variasjoner av dette substratet i det sirkulerende blodet..
De tre gener som koder for heksokinaser I, II og III hos dyr ser ut til å ha den samme forfedren på 50 kDa som ble duplisert og smeltet i genomet, noe som virker tydelig når det observeres at den katalytiske aktiviteten til form I og III bare ligger i enden på C-terminalen.
Referanser
- Aronoff, S. L., Berkowitz, K., Shreiner, B., & Want, L. (2004). Glukosemetabolisme og regulering: utover insulin og glukagon. Diabetes spektrum, 17(3), 183-190.
- Harrington, G. N., og Bush, D. R. (2003). Den bifunksjonelle rollen til heksokinase i metabolisme og glukosesignalering. Plantecellen, femten(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L., og Sheen, J. (1997). Hexokinase som sukkersensor i høyere planter. Plantecellen, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B., & Murata, K. (2005). Hypotese: strukturer, evolusjon og forfader til glukosekinaser i heksokinasefamilien. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, K. E. (1998). Van Holde. Biokjemi.
- Wilson, J. E. (2003). Isozymer av pattedyrs heksokinase: struktur, subcellulær lokalisering og metabolsk funksjon. Journal of Experimental Biology, 206(12), 2049-2057.



Ingen har kommentert denne artikkelen ennå.