
Kjemisk hybridisering sp, sp2, sp3
De kjemisk hybridisering det er "blandingen" av atomorbitaler, som konseptet ble introdusert av kjemiker Linus Pauling i 1931 for å dekke manglene i Valencia Bond Theory (TEV). Hvilke ufullkommenheter? Dette er: molekylgeometrier og ekvivalente bindingslengder i molekyler som metan (CH4).
I følge TEV, i metan, danner C-atomorbitalene fire σ-bindinger med fire H-atomer. 2p-orbitalene, med formasformer (bunnbilde) av C, er vinkelrett på hverandre, så H bør være omtrent noen få fra andre på en 90º vinkel.
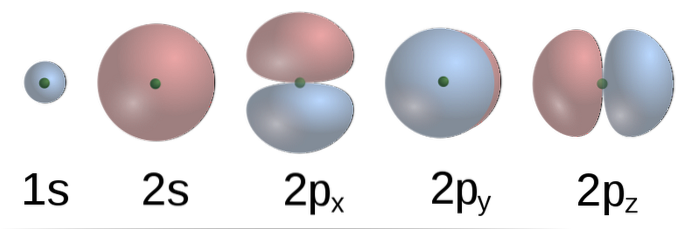
I tillegg binder 2s (sfærisk) bane av C til 1s bane av H i en vinkel på 135 ° i forhold til de andre tre H. Imidlertid har det eksperimentelt blitt funnet at vinklene i CH4 er 109,5 º og at i tillegg er lengden på C-H obligasjonene ekvivalente.
For å forklare dette, må en kombinasjon av de opprinnelige atomorbitalene vurderes til å danne fire degenererte hybridorbitaler (av samme energi). Her kommer kjemisk hybridisering inn. Hvordan er hybridorbitaler? Det avhenger av atomorbitalene som genererer dem. De viser også en blanding av de elektroniske egenskapene til disse.
Artikkelindeks
- 1 sp3 hybridisering
- 1.1 Tolkning
- 1.2 Avvik på bindingsvinkler
- 2 sp2 hybridisering
- 3 sp hybridisering
- 4 Referanser
Sp hybridisering3
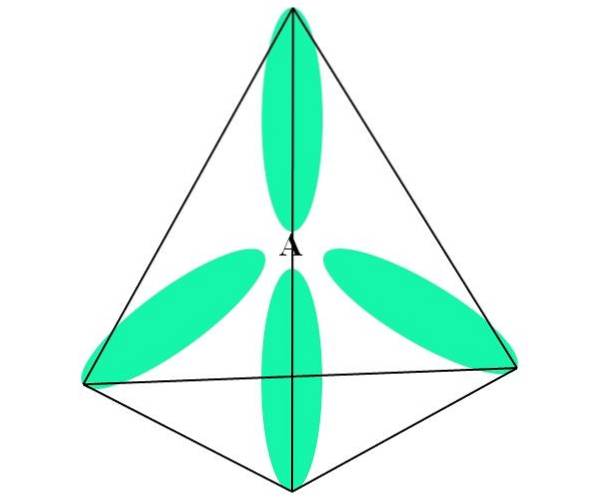
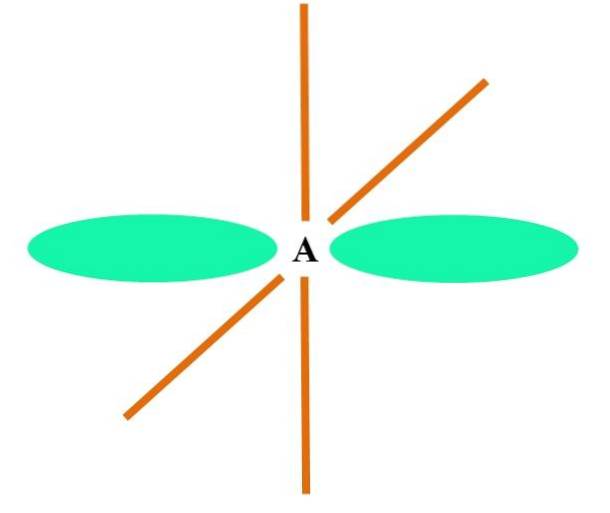
I tilfelle CH4, hybridisering av C er sp3. Fra denne tilnærmingen forklares molekylær geometri med fire sp-orbitaler3 109,5º fra hverandre og peker mot toppunktene til en tetraeder.
På det øvre bildet kan du se hvordan sp orbitaler3 (farget grønt) etablere et tetraedrisk elektronisk miljø rundt atomet (A, som er C for CH4).
Hvorfor 109,5 ° og ikke andre vinkler, for å "tegne" en annen geometri? Årsaken er fordi denne vinkelen minimerer de elektroniske frastøtingene til de fire atomene som binder seg til A.
Dermed CH-molekylet4 kan representeres som en tetraeder (tetrahedral molekylær geometri).
Hvis C, i stedet for H, dannet bindinger med andre grupper av atomer, hva ville da være deres hybridisering? Så lenge karbonet danner fire σ (C-A) bindinger, vil deres hybridisering være sp3.
Det kan følgelig antas at i andre organiske forbindelser som CH3OH, CCl4, C (CH3)4, C6H12 (cykloheksan), etc., har karbon sp-hybridisering3.
Dette er viktig for å tegne organiske strukturer, der enkeltbundet karbon representerer punkter av divergens; det vil si at strukturen ikke forblir i et enkelt plan.
Tolkning
Hva er den enkleste tolkningen for disse hybridorbitalene uten å ta for seg de matematiske aspektene (bølgefunksjonene)? Sp-orbitalene3 antyde at de stammer fra fire orbitaler: en s og tre s.
Fordi kombinasjonen av disse atomorbitalene antas å være ideell, er de fire sp-orbitalene3 resulterende er identiske og opptar forskjellige retninger i rommet (for eksempel i p-orbitalerx, sY Og sz).
Ovennevnte gjelder for resten av mulige hybridiseringer: antall hybridorbitaler som dannes er det samme som for atomorbitalene som kombineres. For eksempel sp hybrid orbitaler3dto er dannet av seks atomorbitaler: ett s, tre p og to d.
Avvik på bindingsvinkel
I følge Valencia Shell Electronic Pair Repulsion Theory (RPECV) opptar et par frie elektroner mer volum enn et bundet atom. Dette får koblingene til å bevege seg fra hverandre, reduserer den elektroniske spenningen og avviker vinklene fra 109,5º:
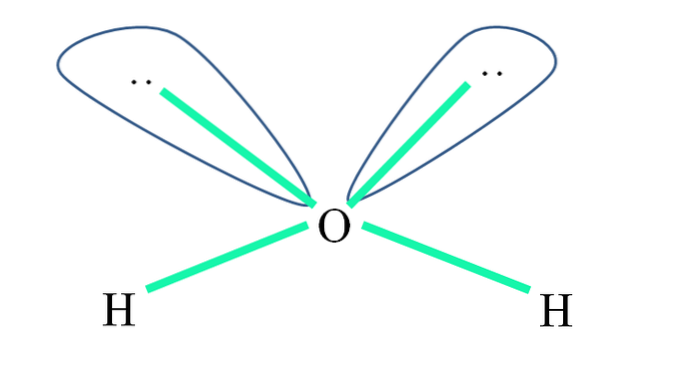
For eksempel er H-atomene i vannmolekylet bundet til sp-orbitalene3 (i grønt), og på samme måte de ikke-delte elektronparene ":" okkuperer disse orbitalene.
Frastøtingen av disse elektronparene blir vanligvis representert som "to kloder med øyne", som på grunn av volumet frastøter de to σ O-H-bindinger..
Således er bindingsvinklene i vann faktisk 105 °, i stedet for 109,5 ° som forventes for tetrahedral geometri..
Hvilken geometri gjør da HtoELLER? Den har en vinkelgeometri. Hvorfor? For selv om den elektroniske geometrien er tetraeder, forvrenger to par ikke-delte elektroner den til en vinkelmolekylær geometri.
Sp hybridiseringto
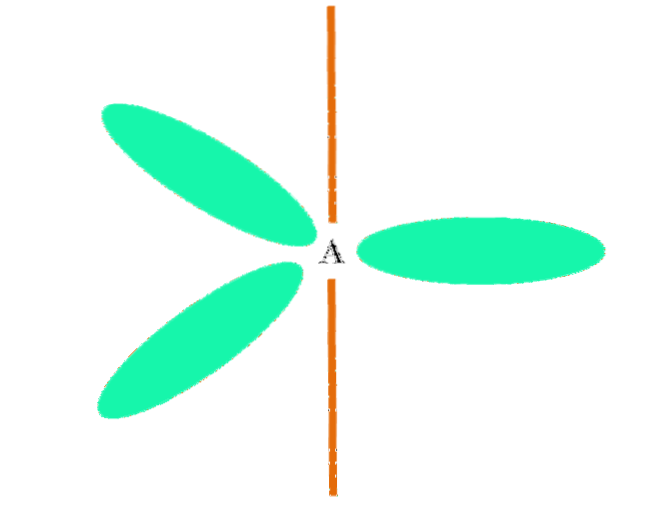
Når et atom kombinerer to p og en s orbitaler, genererer det tre hybrid sp orbitalerto; en p-bane forblir imidlertid uendret (fordi det er tre av dem), som er representert som en oransje strek i det øvre bildet.
Her er de tre sp-orbitaleneto de er farget grønne for å markere forskjellen fra den oransje linjen: den "rene" p-banen.
Et atom med sp hybridiseringto kan visualiseres som et flatt trigonal gulv (trekanten tegnet med sp-orbitaleneto grønt), med sine hjørner atskilt med 120º vinkler og vinkelrett på en stang.
Og hvilken rolle spiller den rene orbitalen? Det å danne en dobbeltbinding (=). Sp orbitaleneto tillate dannelse av tre σ-bindinger, mens den rene p-orbitale π-bindingen (en dobbel eller trippelbinding innebærer en eller to π-bindinger).
For eksempel å tegne karbonylgruppen og strukturen til formaldehydmolekylet (HtoC = O), fortsetter den som følger:
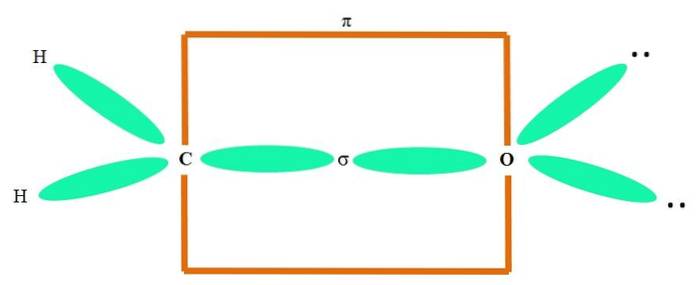
Sp-orbitaleneto både C og O danner en σ-binding, mens deres rene orbitaler danner en π-binding (det oransje rektangelet).
Det kan sees hvordan resten av de elektroniske gruppene (H-atomer og de ikke delte elektronparene) befinner seg i de andre sp-orbitalene.to, atskilt med 120º.
Sp hybridisering
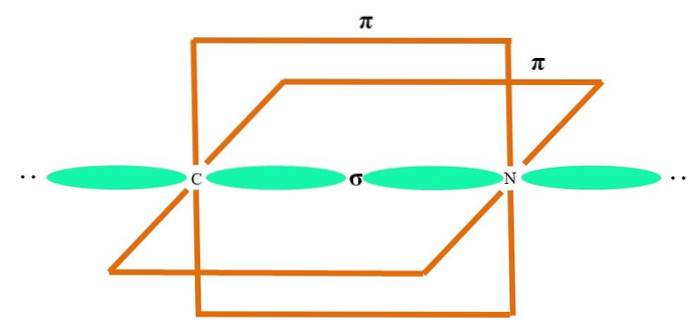
I det øvre bildet er et A-atom med sp-hybridisering illustrert. Her kombineres en s orbital og en p orbital for å gi opphav til to degenererte sp-orbitaler. Imidlertid forblir nå to rene p-orbitaler uendret, som tillater A å danne to dobbeltbindinger eller en trippelbinding (≡).
Med andre ord: hvis en C oppfyller ovenstående i en struktur (= C = eller C =C), så er hybridiseringen sp. For andre mindre illustrerende atomer - som overgangsmetaller - er beskrivelsen av elektroniske og molekylære geometrier komplisert fordi d-orbitalene og til og med f-orbitalene også blir vurdert..
Hybridorbitalene er 180 ° fra hverandre. Av denne grunn er de bundne atomene arrangert i en lineær molekylgeometri (BB-B). Til slutt viser det nedre bildet strukturen til cyanidanionen:
Referanser
- Sven. (3. juni 2006). S-p-Orbitaler. [Figur]. Hentet 24. mai 2018 fra: commons.wikimedia.org
- Richard C. Banks. (Mai 2002). Liming og hybridisering. Hentet 24. mai 2018 fra: chemistry.boisestate.edu
- James. (2018). En hybridiseringssnarvei. Hentet 24. mai 2018 fra: masterorganicchemistry.com
- Dr. Ian Hunt. Institutt for kjemi, University of Calgary. sp3 hybridisering. Hentet 24. mai 2018 fra: chem.ucalgary.ca
- Chemical Bonding II: Molecular Geometry and Hybridization of Atomic Orbitals Chapter 10. [PDF]. Hentet 24. mai 2018 fra: wou.edu
- Quimitube. (2015). Kovalent binding: En introduksjon til Atomic Orbital Hybridization. Hentet 24. mai 2018 fra: quimitube.com
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave., S. 51). Mc Graw Hill.


Ingen har kommentert denne artikkelen ennå.