
Aromatiske hydrokarboneregenskaper, eksempler, anvendelser

De aromatiske hydrokarboner eller arener er et sett med organiske forbindelser som bare består av karbon og hydrogen, og som er preget av å ha benzenringenheter i sine molekylære strukturer.
Noen avgir, som navnet understreker, søte og behagelige lukter; det er derfor de første organiske kjemikerne refererte til dem som aromater. Metangass er for eksempel et luktfritt hydrokarbon; mens toluen, en flyktig væske, har en ganske merkelig og sterk lukt.
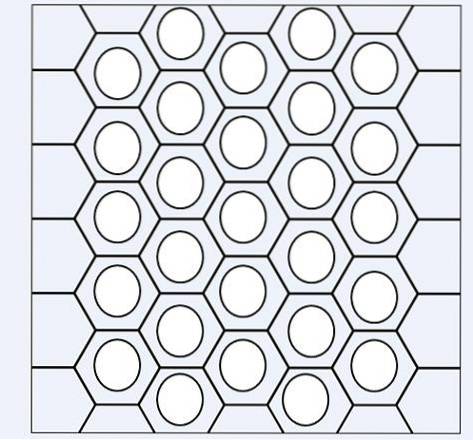
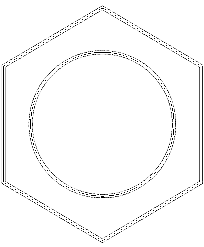
På bildet ovenfor har vi et slags nettverk eller nettverk som består av benzenringer. Legg merke til dens sekskantede geometrier og sirkelen inni. Denne sirkelen representerer det som er kjent som aromaticitet, som er en helt kjemisk og ikke-fysisk egenskap, uavhengig av luktene fra disse hydrokarboner..
Aromatiske hydrokarboner er blant de viktigste stoffene, ekstrahert eller produsert, fra petroleum og karbonmineraler. Benzen er hjørnesteinen i disse hydrokarboner og deres anvendelse, siden den er avledet fra endeløse forbindelser som brukes som råmateriale for produksjon av gjødsel, plast, lim, vaskemidler, parfymer, medisiner etc..
Artikkelindeks
- 1 Hvordan heter aromatiske hydrokarboner??
- 1.1 En enkelt benzenring
- 1.2 Flere ringer
- 2 Egenskaper av aromatiske hydrokarboner
- 2.1 Aromatisitet
- 2.2 Høye C / H-forhold
- 2.3 Gule flammer
- 2.4 Substitusjonsreaksjoner
- 2.5 Dufter
- 3 Eksempler på aromatiske hydrokarboner
- 4 Bruksområder / bruksområder
- 4.1 Fibre og plast
- 4.2 Epoksyharpikser
- 4.3 Vaskemidler
- 4.4 TNT
- 4.5 Benzosyre
- 4.6 Løsningsmidler
- 4.7 Bensin
- 5 Referanser
Hvordan heter aromatiske hydrokarboner??
En enkelt benzenring
For aromatiske hydrokarboner har vi det spesielle at deres tradisjonelle eller vanlige navn pleier å være fremherskende over de som er regulert av IUPAC-nomenklaturen.
De inneholder alle benzenringen, eller en ring som oppfyller egenskapen til aromatisitet. Den enkleste kan navngis basert på benzen og de relative posisjonene til dens substituenter.
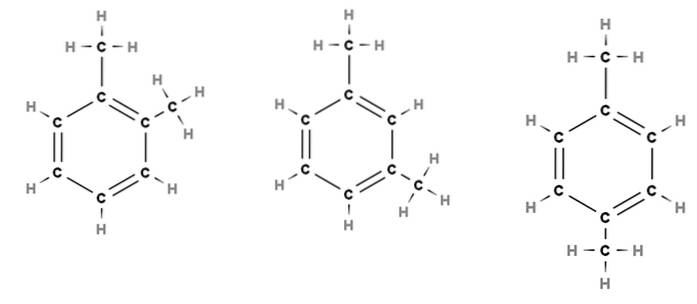
Tenk for eksempel på bildet ovenfor. I de tre strukturene ser vi den sekskantede ringen av benzen, som har to metylsubstituenter, CH3. Dermed kalles denne forbindelsen dimetylbenzen, da den består av en benzen med to metyler.
Fra venstre til høyre ser vi at skillet mellom begge CH3 blir eldre, som ikke bare påvirker de fysiske egenskapene til molekylet, men også endrer deres respektive navn. For å skille dem, siden de alle kalles dimetylbenzen, brukes prefiksene ortho (o-), meta (m-) og para (p-).
Derfor, og igjen, fra venstre til høyre har vi: orto-dimetylbenzen, meta-dimetylbenzen og para-dimetylbenzen. Imidlertid er det tradisjonelle navnet på denne forbindelsen xylen, så navnene kommer til å være: orto-xylen, meta-xylen og para-xylen..
Hvis det er mer enn to forskjellige substituenter, blir karbonene oppregnet etter samme nomenklaturregler som for alle hydrokarboner.
Flere ringer
For aromatiske hydrokarboner med mer enn en benzenring blir de tradisjonelle navnene enda viktigere. Dette er fordi de systematiske navnene som beskriver strukturen deres er tungvint og vanskelig å huske. Tenk på eksemplet med naftalen:
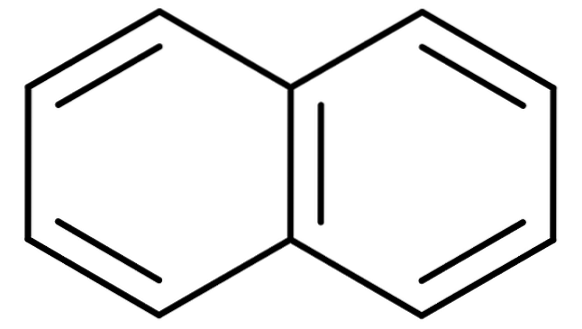
Naftalen er også kjent kommersielt som naftalen eller hvit kamfer. Det systematiske navnet er imidlertid: Bicyclo [4,4,0] deca-1,3,5,7,9 pentaen. Og dette bare for en forbindelse med to smeltede benzenringer; nomenklaturen blir mye mer komplisert for forbindelser med tre eller flere ringer.
Egenskaper av aromatiske hydrokarboner
Aromatisitet
Aromatiske hydrokarboner inneholder ringer som overholder Huckels regler. Det vil si at ringene deres må ha atomer med sp-hybridiseringerto, være så flatt som mulig, og ha et antall avlokaliserte π-elektroner lik 4n + 2. For eksempel er benzen aromatisk fordi den har 6 delokaliserte elektroner til n= 1 (4 · 1 + 2 = 6).
Høye C / H-forhold
C / H-forholdene for aromatiske hydrokarboner er høye eller større enn 1. For eksempel for benzen, C6H6, dens C / H er lik 6/6 eller 1. Mens for naftalen er C10H8, dens C / H er lik 10/8 eller 1,25. Hva betyr dette? At disse hydrokarboner er veldig "karbonatiserte" sammenlignet med andre forbindelser.
Gule flammer
Nettopp på grunn av de høye C / H-forholdene, når aromatiske hydrokarboner brennes, avgir de gulaktig flammer, et produkt av karbonpartiklene som dannes (sot).
Substitusjonsreaksjoner
Aromatiske hydrokarboner kan erstatte deres hydrogenatomer med en hvilken som helst annen substituent. Dette oppnås ved to typer organiske reaksjoner: elektrofil aromatisk substitusjon (SEAr) eller nukleofil aromatisk substitusjon (SNAr)..
Dufter
Aromatiske hydrokarboner, som navnet antyder, er preget av å ha søt eller sterk lukt. Denne egenskapen tillot dem i prinsippet å skille seg fra gassformige hydrokarboner og noen voksagtige parafiner..
Eksempler på aromatiske hydrokarboner
Aromatiske hydrokarboner gjelder strengt tatt bare de som er sammensatt av karbon og hydrogen. Det skal ikke være heteroatomer (O, P, N, S, etc.). Derfor utelater de følgende eksemplene som skal nevnes forbindelser som pyridin, furan eller fenol..
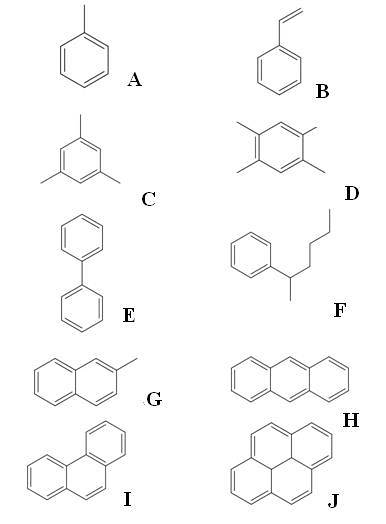
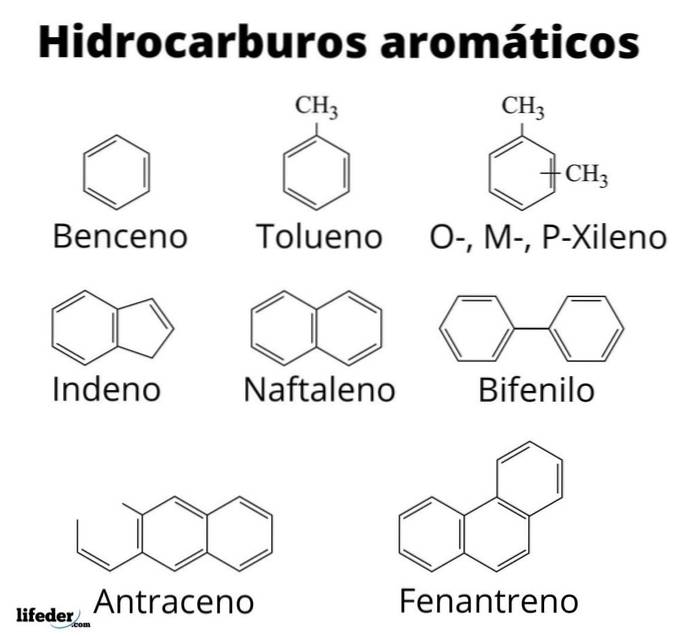
Ovenfor har vi ti eksempler på aromatiske hydrokarboner. Merk at de alle har minst en benzenring. Navnene deres er:
A: Toluen
B: Styren
C: Mesitylene
D: Dureno
E: bifenyl
F: 2-fenylheksan
G: 2-metylnaftalen
H: Antrasene
I: Fenantren
J: Pyrene
Av alle er toluen den med den høyeste industrielle verdien.
Applikasjoner / bruksområder
De fleste anvendelsene av aromatiske hydrokarboner består i å tjene som råmateriale for syntese eller produksjon av produkter med høy kommersiell verdi. Nesten alle starter fra benzen, som utsettes for forskjellige organiske reaksjoner for å oppnå funksjonelle derivater.
Fibre og plast
Sykloheksan produseres av benzen, som senere blir transformert til andre forbindelser for å syntetisere nylon 6 eller nylon 66. På den annen side kan styren, som består av monomeren av polystyren, også fås fra benzen. Dermed har vi polymerer som er nødvendige for produksjon av fibre og plast.
Epoksyharpikser
Fra benzen kan bisfenol A likeledes syntetiseres, som epoxyharpikser, lim, lim og til og med malinger produseres etter forskjellige syntetiske veier..
Vaskemidler
Alkylbenzener med lange sidekjeder brukes til produksjon av vaskemidler; inkludert alkylbenzensulfonater.
TNT
TNT kan produseres av toluen: trinitrotoluen, en av de mest kjente sprengstoffene.
Bensoesyre
Fra toluen oppnås benzoesyre som et derivat, en essensiell forbindelse for formuleringene av mange parfymer, medisiner og matvarer..
Løsningsmidler
Benzen, toluen og xylen (BTX) er de mest brukte organiske løsningsmidlene i petroleumsforskning.
Bensin
Aromatiske hydrokarboner er også en del av sammensetningen av bensin, og har hovedrollen å heve oktantallet eller oktantallet..
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Aromatisk forbindelse. Gjenopprettet fra: en.wikipedia.org
- Ed Vitz et al. (8. september 2020). Aromatiske hydrokarboner. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Wyman Elizabeth. (2020). Aromatiske hydrokarboner: definisjon, eksempler og bruksområder. Studere. Gjenopprettet fra: study.com
- Boluda, C. J., Macías, M., og González Marrero, J. (2019). Kjemisk kompleksitet av bilbensiner. Vitenskap, ingeniørfag og applikasjoner,to(2), 51-79. Doi: doi.org/10.22206/cyap.2019.v2i2.pp51-79


Ingen har kommentert denne artikkelen ennå.