
Umettede hydrokarboneregenskaper og eksempler

De umettede hydrokarboner er de som inneholder minst en karbon dobbeltbinding i strukturen, og som kan inneholde en trippelbinding siden metning av en kjede betyr at den har mottatt alle mulige hydrogenatomer i hvert karbon, og det er ingen par frie elektroner der flere hydrogener kan komme inn.
Umettede hydrokarboner er delt inn i to typer: alkener og alkyner. Alkener er hydrokarbonforbindelser som har en eller flere dobbeltbindinger i molekylet. I mellomtiden er alkyner hydrokarbonforbindelser som har en eller flere trippelbindinger i formelen..
Alkener og alkyner brukes ofte kommersielt. Dette er forbindelser med et høyere nivå av reaktivitet enn det for mettede hydrokarboner, noe som gjør dem til utgangspunktet for mange reaksjoner, generert fra de vanligste alkenene og alkynene..
Artikkelindeks
- 1 Nomenklatur
- 1.1 Nomenklatur for alkener
- 1.2 Nomenklatur av alkyner
- 2 eiendommer
- 2.1 Dobbelt- og trippelbindinger
- 2.2 cis-trans isomerisering
- 2.3 Surhet
- 2.4 Polaritet
- 2.5 Koke- og smeltepunkter
- 3 eksempler
- 3.1 Etylen (C2H4)
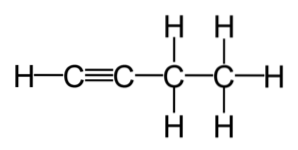
- 3.2 Etin (C2H2)
- 3.3 Propylen (C3H6)
- 3.4 Syklopenten (C5H8)
- 4 Artikler av interesse
- 5 Referanser
Nomenklatur
Umettede hydrokarboner navngis forskjellig avhengig av om de er alkener eller alkyner, ved å bruke suffiksen "-eno" og "-ino".
Alkener har minst en karbon-karbon dobbeltbinding i sin struktur, og har den generelle formelen CnH2n, mens alkyner inneholder minst en trippelbinding og håndteres av formelen CnH2n-2.
Nomenklatur for alkener
For å nevne alkener må posisjonene til karbon-karbon dobbeltbindinger være angitt. Navnene på kjemiske forbindelser som inneholder C = C bindinger slutter med suffikset "-eno".
Som med alkaner, blir navnet på baseforbindelsen bestemt av antall karbonatomer i den lengste kjeden. For eksempel molekylet CHto= CH-CHto-CH3 vil bli kalt "1-buten", men H3C-CH = CH-CH3 vil kalle seg "2-butene".
Tallene som blir observert i navnene på disse forbindelsene indikerer karbonatomet med det minste tallet i kjeden der C = C-bindingen til alkenet er lokalisert..
Antallet karbonatomer i denne kjeden identifiserer prefikset til navnet, som alkaner ("met-", "et-", "pro-", "but-" osv.), Men bruker alltid suffikset "-eno ".
Det må også spesifiseres om molekylet er cis eller trans, som er typer geometriske isomerer. Dette tilsettes i navnet, slik som 3-etyl-cis-2-heptan eller 3-etyl-trans-2-heptan.
Nomenklatur av alkyner
For å gjette navnene på kjemiske forbindelser som inneholder trippel C≡C-bindinger, bestemmes navnet på forbindelsen av antall C-atomer i den lengste kjeden.
I likhet med tilfellet med alkener, angir navnene på alkyner posisjonen der karbon-karbon trippelbinding er funnet; for eksempel i tilfellene av HC2C-CHto-CH3, eller "1-butyne", og H3C-C2C-CH3, eller "2-butyne".
Eiendommer
Umettede hydrokarboner består av et enormt antall forskjellige molekyler, og det er derfor de presenterer en rekke egenskaper som definerer dem, som er identifisert nedenfor:
Dobbelt og tredobbelt binding
De doble og tredobbelte bindingene til alkener og alkyner har spesielle egenskaper som skiller dem fra enkeltbindinger: en enkeltbinding representerer den svakeste av de tre, dannet av en sigmabinding mellom to molekyler.
Dobbeltbindingen dannes av en sigma-binding og en pi, og trippelbindingen av en sigma-binding og to pi. Dette gjør alkenene og alkynene sterkere og krever mer energi for å bryte ned når reaksjoner oppstår..
Videre er bindingsvinklene som er dannet i en dobbeltbinding 120º, mens de i trippelbindingen er 180 °. Dette betyr at molekyler med trippelbindinger har en lineær vinkel mellom disse to karbonene..
Cis-trans isomerisering
I alkener og andre forbindelser med dobbeltbindinger, oppstår en geometrisk isomerisering, som er forskjellig på siden av bindingene der de funksjonelle gruppene som er festet til karbonene som er involvert i denne dobbeltbindingen er funnet..
Når de funksjonelle gruppene til et alken er orientert i samme retning med hensyn til dobbeltbindingen, blir dette molekylet referert til som cis, men når substituentene er i forskjellige retninger, kalles det trans.
Denne isomeriseringen er ikke en enkel forskjell i beliggenhet; forbindelser kan variere sterkt bare fordi de er cis-geometri eller trans-geometri.
Cis-forbindelser involverer vanligvis dipol-dipolkrefter (som har en nettoverdi på null i transs); I tillegg har de høyere polaritet, kokepunkt og smeltepunkter, og har høyere tetthet enn deres kolleger. I tillegg er transforbindelser mer stabile og frigjør mindre forbrenningsvarme..
Surhet
Alkener og alkyner har høyere surhet sammenlignet med alkaner, på grunn av polariteten til deres dobbelt- og trippelbindinger. De er mindre sure enn alkoholer og karboksylsyrer; og av de to er alkyner surere enn alkener.
Polaritet
Polariteten til alkener og alkyner er lav, enda mer i transalkenforbindelser, noe som gjør disse forbindelsene uoppløselige i vann..
Likevel oppløses umettede hydrokarboner lett i vanlige organiske løsningsmidler slik som etere, benzen, karbontetraklorid og andre forbindelser med lav eller ingen polaritet..
Koke- og smeltepunkter
På grunn av deres lave polaritet er kokepunktene og smeltepunktene til umettede hydrokarboner lave, nesten ekvivalente med alkaner som har samme karbonstruktur..
Alkener har likevel lavere kokepunkt og smeltepunkter enn de tilsvarende alkanene, og kan reduseres enda mer hvis de er cis-isomere, som tidligere nevnt..
Derimot har alkyner høyere kokepunkt og smeltepunkter enn alkaner og tilsvarende alkener, selv om forskjellen bare er noen få grader..
Endelig har cykloalkener også lavere smeltetemperaturer enn de tilsvarende cykloalkanene på grunn av stivheten til dobbeltbindingen..
Eksempler
Etylen (CtoH4)
En kraftig kjemisk forbindelse på grunn av sin polymerisering, oksidasjon og halogeneringskapasitet, blant andre egenskaper.
Ethyne (CtoHto)
Også kalt acetylen, det er en brennbar gass som brukes som en nyttig kilde til belysning og varme..
Propylen (C3H6)
Den nest mest brukte forbindelsen i den kjemiske industrien over hele verden, det er et av produktene fra termolyse av petroleum.
Syklopenten (C5H8)
En forbindelse av cykloalkentypen. Dette stoffet brukes som en monomer for syntese av plast.
Artikler av interesse
Mettede hydrokarboner eller alkaner.
Referanser
- Chang, R. (2007). Kjemi, niende utgave. Mexico: McGraw-Hill.
- Wikipedia. (s.f.). Alkenes. Hentet fra en.wikipedia.org
- Boudreaux, K. A. (s.f.). Umettede hydrokarboner. Hentet fra angelo.edu
- Tuckerman, M. E. (s.f.). Alkenes og Alkynes. Hentet fra nyu.edu
- University, L. T. (s.f.). De umettede hydrokarboner: Alkenes og Alkynes. Hentet fra chem.latech.edu



Ingen har kommentert denne artikkelen ennå.