
Hydroksyl (OH) struktur, ion og funksjonelle grupper

De hydroksylgruppe (ÅH) Det er et som har et oksygenatom og ligner et vannmolekyl. Det kan bli funnet som en gruppe, et ion eller en radikal (OH·). I en verden av organisk kjemi, danner det en binding i hovedsak med karbonatomet, selv om det også kan gjøre det med svovel eller fosfor.
På den annen side deltar den i uorganisk kjemi som et hydroksylion (nærmere bestemt hydroksid eller hydroksylion). Det vil si at typen binding mellom den og metallene ikke er kovalent, men ionisk eller koordinert. På grunn av dette er det en veldig viktig "karakter" som definerer egenskapene og transformasjonene til mange forbindelser..

Som det kan sees på bildet ovenfor, er OH-gruppen knyttet til en radikal betegnet med bokstaven R (hvis den er alkyl) eller med bokstaven Ar (hvis den er aromatisk). For ikke å skille mellom de to, er det noen ganger representert knyttet til en "bølge". Avhengig av hva som ligger bak den "bølgen", snakker vi altså om en organisk forbindelse eller en annen..
Hva bidrar OH-gruppen til molekylet som den binder seg til? Svaret ligger i protonene deres, som kan "snappes opp" av sterke baser for å danne salter; de kan også samhandle med andre omkringliggende grupper gjennom hydrogenbindinger. Uansett hvor det er representerer det en potensiell vanndannende region.
Artikkelindeks
- 1 Struktur
- 1.1 Hydrogenbroer
- 2 Hydroksylion
- 3 Dehydrering reaksjon
- 4 Funksjonelle grupper
- 4.1 Alkoholer
- 4.2 Fenoler
- 4.3 Karboksylsyrer
- 5 Referanser
Struktur
Hva er strukturen til hydroksylgruppen? Vannmolekylet er kantet; det vil si at det ser ut som en Boomerang. Hvis de "klipper" en av endene - eller hva som er likt, kan du fjerne en proton - to situasjoner kan oppstå: radikalen (OH·) eller hydroksylionet (OH-). Begge har imidlertid en molekylær lineær geometri (men ikke elektronisk).
Åpenbart skyldes dette at enkle bindinger orienterer to atomer for å holde seg på linje, men det samme skjer ikke med deres hybridorbitaler (ifølge valensbindingsteorien).
På den annen side, siden vannmolekylet er H-O-H og å vite at det er vinkelaktig, endrer H for R eller Ar opprinnelse R-O-H eller Ar-O-H. Her har den eksakte regionen som involverer de tre atomene, vinkelmolekylær geometri, men den for de to O-H-atomene er lineær..
Hydrogenbindinger
OH-gruppen lar molekylene som besitter den samhandle med hverandre gjennom hydrogenbindinger. I seg selv er de ikke sterke, men når antall OH øker i strukturen til forbindelsen, multipliserer deres effekter og reflekteres i de fysiske egenskapene til forbindelsen..
Siden disse broene krever at atomene deres vender mot hverandre, må oksygenatomet i en OH-gruppe danne en rett linje med hydrogenet i en andre gruppe..
Dette gir opphav til veldig spesifikke romlige ordninger, slik som de som finnes i strukturen til DNA-molekylet (mellom nitrogenholdige baser)..
Likeledes er antall OH-grupper i en struktur direkte proporsjonal med affiniteten til vann for molekylet eller omvendt. Hva betyr det? For eksempel gjør sukker, selv om det har en hydrofob karbonstruktur, det store antallet OH-grupper det veldig løselig i vann..
Imidlertid er intermolekylære interaksjoner i noen faste stoffer så sterke at de "foretrekker" å være sammen i stedet for å oppløse i et bestemt løsningsmiddel..
Hydroksylion
Selv om ionet og hydroksylgruppen er veldig like, er deres kjemiske egenskaper veldig forskjellige. Hydroksylionet er en ekstremt sterk base; det vil si at den aksepterer protoner, selv av krefter, for å bli vann.
Hvorfor? Fordi det er et ufullstendig vannmolekyl, negativt ladet og ivrig etter å fullføre med tillegg av et proton.
En typisk reaksjon for å forklare det grunnleggende av dette ionet er følgende:
R-OH + OH- => R-O- + HtoELLER
Dette skjer når en grunnleggende løsning tilsettes en alkohol. Her er alkoksydionen (RO-) assosieres umiddelbart med et positivt ion i oppløsning; det vil si Na-kationen+ (Skorpe).
Siden OH-gruppen ikke trenger å protoneres, er den en ekstremt svak base, men som det fremgår av den kjemiske ligningen, kan den donere protoner, men bare med veldig sterke baser..
På samme måte er det verdt å nevne den nukleofile naturen til OH-. Hva betyr det? Siden det er et veldig lite negativt ion, kan det reise raskt for å angripe positive kjerner (ikke atomkjerner).
Disse positive kjernene er atomer i et molekyl som lider av en elektronisk mangel på grunn av deres elektronegative miljø..
Dehydrering reaksjon
OH-gruppen aksepterer bare protoner i svært sure medier, noe som fører til følgende reaksjon:
R-OH + H+ => R-OtoH+
I dette uttrykket H+ er en sur proton donert av en svært sur art (HtoSW4, HCl, HI, etc.). Her dannes et vannmolekyl, men det er knyttet til resten av den organiske (eller uorganiske) strukturen.
Den positive delladningen på oksygenatomet forårsaker svekkelsen av R-O-bindingentoH+, resulterer i utslipp av vann. Av denne grunn er det kjent som en dehydrasjonsreaksjon, siden alkoholer i sure medier frigjør flytende vann..
Hva kommer så? Dannelsen av det som er kjent som alkener (RtoC = CRto eller RtoC = CHto).
Funksjonelle grupper
Alkoholer
Hydroksylgruppen i seg selv er allerede en funksjonell gruppe: alkoholene. Eksempler på denne typen forbindelse er etylalkohol (EtOH) og propanol (CH3CHtoCHtoÅH).
De er vanligvis blandbare væsker med vann fordi de kan danne hydrogenbindinger mellom molekylene.
Fenoler
En annen type alkoholer er aromater (ArOH). Ar betegner et arylradikal, som ikke er noe mer enn en benzenring med eller uten alkylsubstituenter.
Aromatisiteten til disse alkoholene gjør dem motstandsdyktige mot sure protonangrep; med andre ord, de kan ikke bli dehydrert (så lenge OH-gruppen er direkte festet til ringen).
Dette er tilfellet med fenol (C6H5ÅH):
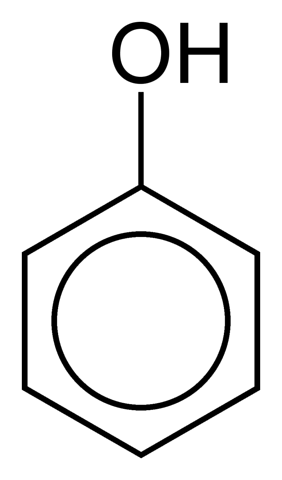
Fenolringen kan være en del av en større struktur, som i aminosyren tyrosin.
Karboksylsyrer
Til slutt utgjør hydroksylgruppen syrekarakteren til karboksylgruppen som er tilstede i organiske syrer (-COOH). Her, i motsetning til alkoholer eller fenoler, er OH veldig surt, og protonen blir donert til sterke eller litt sterke baser..
Referanser
- Helmenstine, Anne Marie, Ph.D. (7. februar 2017). Definisjon av Hydroxyl Group. Hentet fra: thoughtco.com
- Wikipedia. (2018). Hydroksygruppe. Hentet fra: en.wikipedia.org
- Biologiprosjektet. (25. august 2003). Hydroksylaminosyrer. Institutt for biokjemi og molekylær biofysikk University of Arizona. Hentet fra: biology.arizona.edu
- Dr. J.A. Colapret. Alkoholer. Hentet fra: colapret.cm.utexas.edu
- Quimicas.net (2018). Hydroxyl Group. Gjenopprettet fra: quimicas.net
- Dr. Ian Hunt. Dehydrering av alkoholer. Institutt for kjemi, University of Calgary. Hentet fra: chem.ucalgary.ca



Ingen har kommentert denne artikkelen ennå.