
Litiumhydridstruktur, egenskaper, produksjon, bruksområder

De litiumhydrid det er et krystallinsk uorganisk fast stoff som har kjemisk formel LiH. Det er det letteste uorganiske saltet, dets molekylvekt er bare 8 g / mol. Den er dannet av foreningen av et litiumion Li+ og et hydridion H-. Begge er bundet av en ionebinding.
LiH har høyt smeltepunkt. Den reagerer lett med vann og hydrogengass produseres i reaksjonen. Det kan oppnås ved omsetning mellom smeltet litiummetall og hydrogengass. Det er mye brukt i kjemiske reaksjoner for å oppnå andre hydrider.
LiH har blitt brukt til å beskytte mot farlig stråling som de som finnes i atomreaktorer, det vil si ALPHA, BETA, GAMMA-stråling, protoner, røntgen og nøytroner..
Det er også blitt foreslått for beskyttelse av materialer i romraketter drevet av kjernefysisk fremdrift. Studier utføres til og med for å brukes som beskyttelse av mennesket mot kosmisk stråling under fremtidige turer til planeten Mars..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3.5 Selvantennelsestemperatur
- 3.6 Tetthet
- 3.7 Løselighet
- 3.8 Andre egenskaper
- 4 Motta
- 5 Bruk som et beskyttende skjold mot farlig stråling
- 5.1 - I atomreaktorer
- 5.2 - I romsystemer med kjernefysisk fremdrift
- 5.3 - I beskyttelse mot kosmisk stråling
- 6 Bruk som et middel for sikker lagring og transport av hydrogen
- 7 Bruk i kjemiske reaksjoner
- 8 Referanser
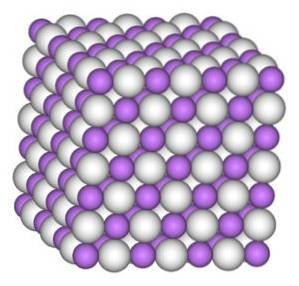
Struktur
Hydrogen i litiumhydrid har en negativ ladning H-, siden den har trukket et elektron fra metallet, som er i form av et Li-ion+.
Elektronkonfigurasjonen til Li-kationen+ er: [Han] 1sto som er veldig stabil. Og den elektroniske strukturen til hydridanionen H- er: 1sto, som også er veldig stabil.
Kationet og anionet er forbundet med elektrostatiske krefter.
Litiumhydridkrystallet har samme struktur som natriumklorid NaCl, det vil si en kubisk krystallstruktur.
Nomenklatur
- Litiumhydrid
- LiH
Eiendommer
Fysisk tilstand
Hvitt eller fargeløst krystallinsk fast stoff. Kommersiell LiH kan være blågrå på grunn av tilstedeværelsen av små mengder litiummetall..
Molekylær vekt
8 g / mol
Smeltepunkt
688 ºC
Kokepunkt
Den nedbrytes ved 850 ºC.
Selvantennelsestemperatur
200 ºC
Tetthet
0,78 g / cm3
Løselighet
Reagerer med vann. Det er uoppløselig i etere og hydrokarboner.
Andre egenskaper
Litiumhydrid er mye mer stabilt enn hydrider av de andre alkalimetallene og kan smeltes uten spaltning..
Det påvirkes ikke av oksygen hvis det varmes opp til temperaturer under rødt. Det er også upåvirket av klor Clto og saltsyre HC1.
Kontakten av LiH med varme og fuktighet forårsaker en eksoterm reaksjon (genererer varme) og utvikling av hydrogen Hto og litiumhydroksyd LiOH.
Det kan danne et fint støv som kan eksplodere i kontakt med flammer, varme eller oksiderende materialer. Det må ikke komme i kontakt med lystgass eller flytende oksygen, da det kan eksplodere eller antennes.
Det blir mørkere når det utsettes for lys.
Å skaffe
Litiumhydrid er oppnådd i laboratoriet ved omsetning mellom smeltet litiummetall og hydrogengass ved en temperatur på 973 K (700 ºC).
2 Li + Hto → 2 LiH
Gode resultater oppnås når den eksponerte overflaten av det smeltede litium økes og når sedimentasjonstiden til LiH reduseres. Det er en eksoterm reaksjon.
Brukes som et beskyttende skjold mot farlig stråling
LiH har en rekke egenskaper som gjør det attraktivt for bruk som beskyttelse for mennesker i atomreaktorer og romsystemer. Her er noen av disse egenskapene:
- Den har et høyt innhold av hydrogen (12,68 vekt% H) og et høyt antall hydrogenatomer per volumsenhet (5,85 x 1022 H-atomer / cm3).
- Det høye smeltepunktet gjør at den kan brukes i miljøer med høy temperatur uten å smelte.
- Den har et lavt dissosiasjonstrykk (~ 20 torr ved smeltepunktet) som gjør at materialet kan smeltes og frosses uten å brytes ned under lavt hydrogentrykk..
- Den har lav tetthet som gjør den attraktiv for bruk i romsystemer..
- Ulempene er imidlertid dens lave varmeledningsevne og dårlige mekaniske egenskaper. Men dette har ikke redusert anvendeligheten.
- LiH-delene som fungerer som skjold produseres ved varm- eller kaldpressing og ved smelting og helling i former. Selv om denne siste formen er foretrukket.
- Ved romtemperatur er delene beskyttet mot vann og vanndamp og ved høye temperaturer ved et lite overtrykk av hydrogen i en forseglet beholder..
- I atomreaktorer
I atomreaktorer er det to typer stråling:
Direkte ioniserende stråling
De er svært energiske partikler som bærer elektrisk ladning, som alfa (α) og beta (β) partikler og protoner. Denne typen stråling samhandler veldig sterkt med materialene i skjoldene, og forårsaker ionisering ved å samhandle med elektronene til atomene til materialene de passerer gjennom..
Indirekte ioniserende stråling
De er nøytroner, gammastråler (γ) og røntgenstråler, som trenger gjennom og krever massiv beskyttelse, siden de involverer utslipp av sekundærladede partikler, som er de som forårsaker ionisering..

I følge noen kilder er LiH effektivt til å beskytte materialer og mennesker mot denne typen stråling.
- I romsystemer med kjernefysisk fremdrift
LiH har nylig blitt valgt som en potensiell moderator og kjernefysisk strålingsskjermingsmateriale for kjernefysiske termiske fremdriftssystemer med veldig lang fartstid..

Dens lave tetthet og høye hydrogeninnhold gjør det mulig å redusere massen og volumet til den kjernefysiske reaktoren effektivt..
- I beskyttelse mot kosmisk stråling
Eksponering for romstråling er den viktigste risikoen for menneskers helse i fremtidige interplanetære utforskningsoppdrag.
I det dype rommet vil astronauter bli utsatt for hele spekteret av galaktiske kosmiske stråler (ioner med høy energi) og utslippshendelser fra solpartikler (protoner)..
Faren for strålingseksponering forsterkes av lengden på oppdragene. I tillegg må beskyttelsen av stedene som oppdagelsesreisende bor, også vurderes.

På denne måten indikerte en studie utført i 2018 at LiH gir blant de testede materialene den største reduksjonen i stråling per gram per cmto, dermed en av de beste kandidatene som skal brukes i beskyttelsen mot kosmisk stråling. Imidlertid må disse studiene utdypes.
Brukes som et sikkert lagrings- og transportmedium for hydrogen
Å skaffe energi fra Hto Det er noe som har blitt studert i flere titalls år, og som allerede har funnet anvendelse for å erstatte fossile brensler i transportkjøretøyer.
Hto kan brukes i brenselceller og bidra til reduksjon av CO-produksjonto og neix, og dermed unngå drivhuseffekten og forurensning. Imidlertid har et effektivt system for lagring og transport av H ennå ikke blitt funnetto trygt, lett, kompakt eller liten i størrelse, rask å lagre og frigjøre Hto like raskt.
Litiumhydrid LiH er en av alkalihydridene som har den høyeste lagringskapasiteten for Hto (12,7 vekt-% H). Slipp Hto ved hydrolyse i henhold til følgende reaksjon:
LiH + HtoO → LiOH + Hto
LiH leverer 0,254 kg hydrogen for hvert kg LiH. I tillegg har den høy lagringskapasitet per volumsenhet, noe som betyr at den er lett og er et kompakt medium for lagring av Hto.

I tillegg dannes LiH lettere enn andre alkalimetallhydrider og er kjemisk stabil ved omgivelsestemperaturer og trykk. LiH kan transporteres fra produsent eller leverandør til brukeren. Deretter genereres H ved hydrolyse av LiHto og dette brukes trygt.
Det dannede litiumhydroksyd LiOH kan returneres til leverandøren som regenererer litium ved elektrolyse, og deretter produserer LiH igjen..
LiH har også blitt studert med suksess for å brukes i forbindelse med borert hydrazin for samme formål..
Bruk i kjemiske reaksjoner
LiH tillater syntese av komplekse hydrider.
Den brukes for eksempel til å fremstille litium trietylborhydrid, som er en kraftig nukleofil i organiske halogenidforskyvningsreaksjoner..
Referanser
- Sato, Y. og Takeda, O. (2013). Hydrogenlagrings- og transportsystem gjennom litiumhydrid ved bruk av smeltet saltteknologi. I smeltet saltkjemi. Kapittel 22, side 451-470. Gjenopprettet fra sciencedirect.com.
- OSS. National Library of Medicine. (2019). Litiumhydrid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Wang, L. et al. (2019). Undersøkelse av innvirkningen av termisk kjerneeffekt av litiumhydrid på reaktiviteten til kjerneproduksjonspartikkelbedreaktor. Annaler om kjernekraft 128 (2019) 24-32. Gjenopprettet fra sciencedirect.com.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Giraudo, M. et al. (2018). Akseleratorbaserte tester av skjermingseffektivitet av forskjellige materialer og flerlag ved bruk av høyenergi lette og tunge ioner. Strålingsforskning 190; 526-537 (2018). Gjenopprettet fra ncbi.nlm.nih.gov.
- Welch, F.H. (1974). Litiumhydrid: Et romalderbeskyttende materiale. Nuclear Engineering and Design 26, 3, februar 1974, side 444-460. Gjenopprettet fra sciencedirect.com.
- Simnad, M.T. (2001). Atomreaktorer: Skjermingsmaterialer. In Encyclopedia of Materials: Science and Technology (Andre utgave). Sider 6377-6384. Gjenopprettet fra sciencedirect.com.
- Hügle, T. et al. (2009). Hydrazine Borane: Et lovende materiale for lagring av hydrogen. J. Am. Chem. Soc. 2009, 131, 7444-7446. Gjenopprettet fra pubs.acs.org.



Ingen har kommentert denne artikkelen ennå.