
Kalsiumhydroksyd (Ca (OH) 2) struktur, egenskaper, produksjon, bruksområder

De kalsiumhydroksid er en uorganisk forbindelse med kjemisk formel Ca (OH)to. Det er et hvitt pulver som har vært i bruk i tusenvis av år, i løpet av hvilken tid det har fått flere tradisjonelle navn eller kallenavn; blant dem kan vi nevne slakk, død, kjemisk, hydrert eller fin kalk.
I naturen er den tilgjengelig i et sjeldent mineral kalt portlanditt, av samme farge. På grunn av dette Ca (OH)to Det oppnås ikke direkte fra dette mineralet, men fra en varmebehandling, etterfulgt av hydrering, av kalkstein. Fra dette oppnås kalk, CaO, som senere slukkes eller hydratiseres for å produsere Ca (OH)to.

Ca (OH)to det er en relativt svak base i vann, siden den knapt kan oppløses i varmt vann; men løseligheten øker i kaldt vann, fordi hydratiseringen er eksoterm. Imidlertid fortsetter dens grunnleggende å være en grunn til å være forsiktig med den under håndtering, da det kan forårsake forbrenning i hvilken som helst del av kroppen..
Det har blitt brukt som en pH-regulator for forskjellige materialer eller matvarer, i tillegg til å være en god kalsiumkilde når det gjelder massen. Den har applikasjoner i papirindustrien, i desinfisering av kloakk, i hårfjerningsprodukter, i matvarer laget av maismel.
Imidlertid har den viktigste bruken vært som et konstruksjonsmateriale, siden kalk hydratiseres når det blandes med de andre ingrediensene i gips eller mørtel. I disse herdede blandingene, Ca (OH)to absorberer karbondioksid fra luften for å konsolidere sandkrystaller sammen med de som er dannet av kalsiumkarbonat.
Foreløpig utføres det fortsatt forskning med sikte på å utvikle bedre byggematerialer som har Ca (OH)to direkte i sammensetningen som nanopartikler.
Artikkelindeks
- 1 Struktur
- 1.1 Krystall og dets ioner
- 1.2 Morfologi
- 2 eiendommer
- 2.1 Fysisk utseende
- 2.2 Molarmasse
- 2.3 Smeltepunkt
- 2.4 Tetthet
- 2,5 pH
- 2.6 Løselighet i vann
- 2,7 Kps
- 2.8 Brytningsindeks
- 2.9 Stabilitet
- 3 Motta
- 4 bruksområder
- 4.1 Matbehandling
- 4.2 Avløpsdesinfeksjonsmiddel
- 4.3 Papirindustri
- 4.4 Gassabsorber
- 4.5 Personlig pleie
- 4.6 Byggearbeider
- 5 Risiko og bivirkninger
- 6 Referanser
Struktur
Krystall og dets ioner
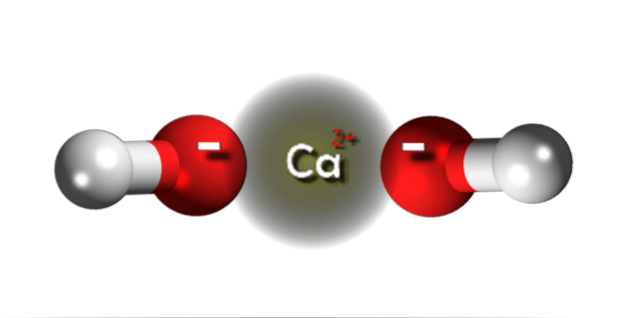
På det øvre bildet har vi ionene som utgjør kalsiumhydroksid. Den samme formelen Ca (OH)to påpeker at for hvert kation Cato+ det er to OH-anioner- som samhandler med det gjennom elektrostatisk tiltrekning. Resultatet er at begge ionene ender med å etablere en krystall med en sekskantet struktur.
I slike sekskantede krystaller av Ca (OH)to ionene er veldig nær hverandre, noe som gir utseendet til å være en polymer struktur; selv om det ikke er formelt en Ca-O kovalent binding gitt den bemerkelsesverdige forskjellen i elektronegativitet mellom de to elementene.
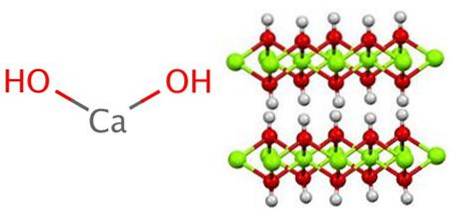
Strukturen genererer octahedra CaO6, det vil si Cato+ samhandler med seks OH- (ACto+-Åh-).
En serie av disse oktaedraene utgjør et lag av krystallet, som kan samhandle med et annet gjennom hydrogenbindinger som holder dem intermolekylært sammenhengende; denne interaksjonen forsvinner imidlertid ved en temperatur på 580 ° C når Ca (OH) er dehydrertto til CaO.
På siden av høyt trykk er det ikke mye informasjon i denne forbindelse, selv om studier har vist at ved et trykk på 6 GPa gjennomgår den sekskantede krystall en overgang fra den sekskantede til den monokliniske fasen; og med det, deformasjonen av oktaedra CaO6 og dens lag.
Morfologi
Krystallene til Ca (OH)to De er sekskantede, men det er ikke en hindring for dem å vedta noen morfologi. Noen av disse strukturene (som tråder, flak eller bergarter) er mer porøse enn andre, robuste eller flate, noe som direkte påvirker deres endelige applikasjoner..
Dermed er det ikke det samme å bruke krystaller fra mineralet portlanditt, enn å syntetisere dem slik at de består av nanopartikler hvor noen få strenge parametere følges; slik som graden av hydrering, konsentrasjonen av CaO og den tiden krystallet får vokse.
Eiendommer
Fysisk utseende
Hvitt, luktfritt, pulverformig fast stoff med en bitter smak.
Molarmasse
74,093 g / mol
Smeltepunkt
580 ° C Ved denne temperaturen spaltes det slippende vann, så det når aldri fordampning:
Ca (OH)to => CaO + HtoELLER
Tetthet
2.211 g / cm3
pH
En mettet vandig løsning av den samme har en pH på 12,4 ved 25 ºC.
Vannløselighet
Løseligheten til Ca (OH)to i vann synker det med en økning i temperaturen. For eksempel er løseligheten ved 0 ° C 1,89 g / L; mens de er ved 20 ° C og 100 ° C, er disse henholdsvis 1,73 g / L og 0,66 g / L.
Dette indikerer et termodynamisk faktum: hydrering av Ca (OH)to er eksoterm, så å følge Le Chateliers prinsipp vil ligningen være:
Ca (OH)to <=> ACto+ + 2OH- + Spørsmål
Hvor Q er varmen som frigjøres. Jo varmere vannet er, desto mer vil likevekten ha en tendens til venstre; det vil si mindre Ca (OH) vil oppløsesto. Det er av denne grunn at det i kaldt vann løses opp mye mer enn i kokende vann..
På den annen side øker løseligheten hvis pH blir sur på grunn av nøytraliseringen av OH-ionene.- og forskyvningen av den fremre likevekten til høyre. Enda mer varme frigjøres under denne prosessen enn i nøytralt vann. I tillegg til sure vandige oppløsninger, Ca (OH)to det er også løselig i glyserol.
Kps
5,5 10-6. Denne verdien anses som liten og er i samsvar med den lave løseligheten av Ca (OH)to i vannet (samme balanse som ovenfor).
Brytningsindeks
1,574
Stabilitet
Ca (OH)to forblir stabil så lenge den ikke utsettes for COto fra luften, da den absorberer den og danner kalsiumkarbonat, CaCO3. Derfor begynner det å bli forurenset til en fast blanding av Ca (OH) krystallerto-Tyv3, der det er CO-anioner3to- konkurrerer med OH- å samhandle med Cato+:
Ca (OH)to + COto => CaCO3 + HtoELLER
Dette er faktisk grunnen til at konsentrerte løsninger av Ca (OH)to de blir melkeaktige, ettersom det oppstår en suspensjon av CaCO-partikler3.
Å skaffe
Ca (OH)to Det oppnås kommersielt ved å reagere kalk, CaO, med et to til tre ganger overskudd av vann:
CaO + HtoO => Ca (OH)to
Imidlertid kan karbonisering av Ca (OH) forekommeto, akkurat som forklart ovenfor.
Andre metoder for å oppnå det er å bruke oppløselige kalsiumsalter, slik som CaClto eller Ca (NO3)to, og gjør dem basiske med NaOH, slik at Ca (OH) faller utto. Ved å kontrollere parametere som vannvolum, temperatur, pH, løsemiddel, karboniseringsgrad, modningstid osv., Kan nanopartikler med forskjellige morfologier syntetiseres.
Den kan også tilberedes ved å velge naturlige og fornybare råvarer, eller avfall fra en industri som er rik på kalsium, som når den blir oppvarmet og behandlet, vil asken bestå av kalk; og herfra kan Ca (OH) igjen fremstillesto ved å hydrere denne asken uten å kaste bort kalkstein, CaCO3.
For eksempel har agave bagasse blitt brukt til dette formålet, og tilordnet merverdi til avfall fra tequilaindustrien..
applikasjoner
Matforedling

Kalsiumhydroksid er til stede i mange matvarer i noen av tilberedningstrinnene. For eksempel dyppes sylteagurk, som agurk, i en vandig løsning av den for å gjøre dem mer skarpe når de pakkes i eddik. Dette er fordi proteinene på overflaten absorberer kalsium fra mediet..
Det samme skjer med maiskorn før de omdannes til mel, da det hjelper med å frigjøre vitamin B3 (niacin) og gjør det lett å male. Kalsiumet det tilføres brukes også til å gi næringsverdi til visse juice.
Ca (OH)to Det kan også erstatte bakepulver i noen brødoppskrifter, og avklare de sukkerholdige løsningene som oppnås fra sukkerrør og rødbeter..
Avløpsdesinfeksjonsmiddel
Den avklarende handlingen til Ca (OH)to Det er fordi det fungerer som et flokkuleringsmiddel; det vil si at den øker størrelsen på de suspenderte partiklene til de danner flokker, som senere legger seg eller kan filtreres.
Denne eiendommen har blitt brukt til å desinfisere kloakk, og destabiliserer kolloidene som er ubehagelige for tilskuere (og lukten)..
Papirindustri
Ca (OH)to den brukes i Kraft-prosessen for å regenerere NaOH som brukes til å behandle tre.
Gassabsorber
Ca (OH)to brukes til å fjerne COto av lukkede rom eller i miljøer der deres tilstedeværelse er kontraproduktiv.
Personlig pleie
I formuleringer for hårfjerningskremer Ca (OH)to Det blir stiltiende funnet, siden dets grunnleggende hjelp hjelper til med å svekke hårets keratin, og dermed er det lettere å fjerne dem.
Konstruksjon

Ca (OH)to Det har vært til stede siden uminnelige tider, og integrerte massene av gips og mørtel som ble brukt til bygging av egyptiske arkitektoniske arbeider som pyramidene; også bygninger, mausoleer, vegger, trapper, gulv, støtter og til og med for å gjenoppbygge tannlegesement.
Den befestende handlingen skyldes at når du "puster" COto, de resulterende krystallene av CaCO3 fullfør integreringen av sanden og de andre komponentene i slike blandinger i bedre grad.
Risiko og bivirkninger
Ca (OH)to Det er ikke et sterkt basisk fast stoff sammenlignet med andre hydroksider, selv om det er mer enn Mg (OH)to. Til tross for at den ikke er reaktiv eller brennbar, er dens grunnleggende fremdeles aggressiv nok til å forårsake mindre forbrenninger..
Derfor må det håndteres med respekt, da det er i stand til å irritere øyne, tunge og lunger, samt utløse andre sykdommer som: tap av syn, alvorlig alkalisering av blodet, hudutslett, oppkast og ondt i halsen.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Kalsiumhydroksid. Gjenopprettet fra: en.wikipedia.org
- Chávez Guerrero et al. (2016). Syntese og karakterisering av kalsiumhydroksyd oppnådd fra agave bagasse og undersøkelse av dets antibakterielle aktivitet. Gjenopprettet fra: scielo.org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Krystallstruktur av høytrykksfasen av kalsiumhydroksid, portlanditt: In situ pulver og enkeltkrystall røntgendiffraksjonsstudie. Amerikansk mineralog; 98 (8-9): 1421-1428. doi: doi.org/10.2138/am.2013.4386
- Hans Lohninger. (5. juni 2019). Kalsiumhydroksid. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Aniruddha S. et al. (2015). Syntese av nanokalsiumhydroksyd i vandig medium. The American Ceramic Society. doi.org/10.1111/jace.14023
- Carly Vandergriendt. (12. april 2018). Hvordan brukes kalsiumhydroksid i mat, og er det trygt? Gjenopprettet fra: healthline.com
- Brian Clegg. (26. mai 2015). Kalsiumhydroksid. Gjenopprettet fra: chemistryworld.com

Ingen har kommentert denne artikkelen ennå.