
Incretin-typer og deres struktur, funksjoner, virkningsmekanisme
De inkretin er gastrointestinale hormoner som stimulerer utskillelsen av fysiologiske konsentrasjoner av insulin. Begrepet brukes for tiden til to forskjellige tarmhormoner, som har forskjellige tekniske navn: GIP eller "glukoseavhengig insulinotropisk polypeptid" og GLP-1 eller "glukagonlignende peptid 1".
"Incretin" er et ord og et konsept som ble laget i 1932 av den belgiske fysiologen Jean La Barre, som introduserte det for å definere de intestinale hormonelle faktorene som kompletterte effekten av sekretin på endokrin bukspyttkjertelsekresjon..
La Barre brukte med andre ord betegnelsen inkretin for å betegne ethvert tarmhormon som under fysiologiske forhold var i stand til å stimulere eller bidra til utskillelsen av pankreashormoner som insulin, glukagon, bukspyttkjertelpolypeptid (PP) og somatostatin..
Imidlertid brukes for tiden begrepet "inkretin" bare for å betegne de hormoner som er i stand til å stimulere glukoseavhengig pankreasinsulinsyntese, spesielt to peptider kjent som GIP og GLP-1. Imidlertid kan innføringen av ny teknologi og dypere endokrinologiske studier avsløre mange andre peptider med lignende aktiviteter..
Artikkelindeks
- 1 Typer inkretiner og deres struktur
- 2 funksjoner
- 3 Handlingsmekanisme
- 3.1 GIP: Glukoseavhengig insulinotropisk polypeptid
- 3.2 GLP-1: Glukagonlignende peptid 1
- 4 Referanser
Typer inkretiner og deres struktur
Tradisjonelt har bare to inkretiner blitt definert hos mennesker: glukoseavhengig insulinotropisk polypeptid (GIP) og glukagon-lignende peptid 1 (GLP-1); de to hormonene virker i tillegg til å stimulere insulinsekresjon.
Den første av disse som ble isolert var glukoseavhengig insulinotropisk polypeptid (GIP). Glukoseavhengig Insulinotropisk polypeptid). Det er et peptidhormon med ca. 42 aminosyrer og tilhører glukagon-sekretinfamilien av peptider.

Det andre inkretinet som ble oppdaget var glukagonlignende peptid 1 (GLP-1). Glukagonlignende peptid-1), som er et biprodukt av genet som koder for hormonet "proglucagon"; del av den C-terminale enden av proteinet, for å være mer nøyaktig.
Funksjoner
Opprinnelig ble inkretiner definert som faktorer avledet fra tarmkanalen som har evnen til å senke plasmaglukosenivået gjennom stimulering av sekresjonen av bukspyttkjertelhormoner som insulin og glukagon..
Dette konseptet ble opprettholdt med fremkomsten av radioimmunoanalyser, hvor permanent kommunikasjon mellom tarmen og den endokrine bukspyttkjertelen ble bekreftet..
Oral glukoseadministrasjon ble vist å være assosiert med signifikante økninger i plasmainsulinnivået, spesielt sammenlignet med resultater oppnådd med intravenøs glukose..
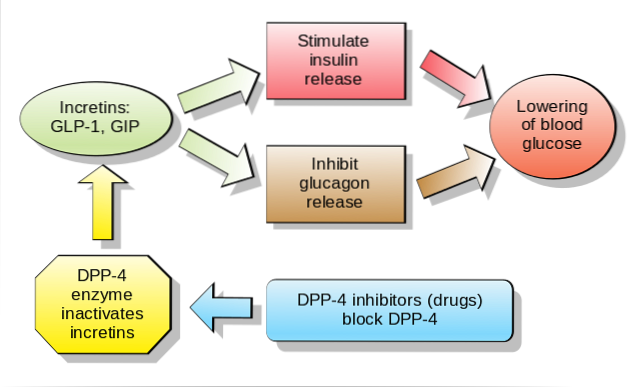
Det antas at inkretiner er ansvarlige for utskillelsen av nesten 70% av plasmainsulin etter oral administrering av glukose, ettersom de er hormoner som skilles ut som respons på næringsinntak, noe som forbedrer utskillelsen av glukoseinsulin..
Det arbeides for tiden med hensyn til oral eller intravenøs administrering av inkretiner til pasienter med sykdommer som type 2 diabetes mellitus eller oral glukoseintoleranse. Dette er fordi studier har vist, om enn foreløpig, at disse stoffene letter den raske reduksjonen i glykemiske nivåer etter inntak av mat..
Virkningsmekanismen
GIP: Glukoseavhengig insulinotropisk polypeptid
Dette inkretinet produseres av K-cellene i tynntarmen (spesifikt i tolvfingertarmen og jejunum) som svar på inntak av fett eller glukose, og er ansvarlig for å øke glukosestimulert insulinsekresjon..
Ekspresjonen av genet som koder for denne hormonelle faktoren har blitt demonstrert hos mennesker og gnagere både i magen og i tarmen. Studier utført med dette hormonet indikerer at det er avledet fra en 153 aminosyre "proGIP" forløper, som har to signalpeptider i sine N- og C-terminale ender, som spaltes for å gi et aktivt peptid med 42 rester..
Halveringstiden til GIP er mindre enn 7 minutter når den er syntetisert og enzymatisk behandlet. Dette peptidet gjenkjennes av en spesifikk reseptor, GIPR, som er lokalisert i plasmamembranen i cellene i bukspyttkjertelen, i magen, i tynntarmen, i fettvev, i binyrebarken, i hypofysen, i hjertet, lungene og andre store organer.
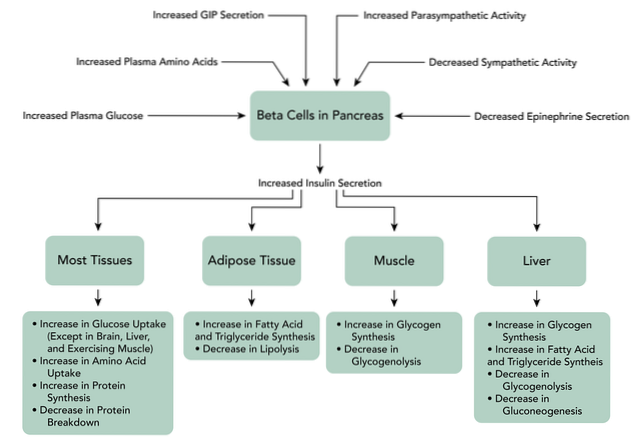
Når GIP binder seg til reseptorene på betacellene i bukspyttkjertelen, utløser det en økning i produksjonen av cAMP, også inhibering av ATP-avhengige kaliumkanaler, økningen i intracellulært kalsium og til slutt eksocytosen av insulinlagringskornene..
I tillegg kan dette peptidet stimulere gentranskripsjon og insulinbiosyntese, så vel som de andre komponentene i betaceller i bukspyttkjertelen til "folketelling" glukose. Selv om GIP hovedsakelig fungerer som et inkretinhormon, utøver det også andre funksjoner i andre vev som sentralnervesystemet, blant annet bein..
GLP-1: Glukagonlignende peptid 1
Dette peptidet er produsert fra genet som koder for "proglukagon", så det er et peptid som deler nær 50% identitet med glukagon-sekvensen og kalles derfor "glukagon-lignende" peptid.
GLP-1, et post-translasjonelt proteolytisk produkt, er vevsspesifikt og produseres av L-cellene i tarmen som svar på matinntak. I likhet med GIP har dette inkretin evnen til å øke glukosestimulert insulinsekresjon.
Genuttrykk og prosessering
Dette peptidet er kodet i et av eksonene i proglucagon-genet, som uttrykkes i alfa-cellene i bukspyttkjertelen, i L-cellene i tarmen (i det distale ileum) og i nerveceller i hjernestammen og hypothalamus.
I bukspyttkjertelen stimuleres ekspresjonen av dette genet ved faste og hypoglykemi (lave konsentrasjoner av glukose i blodet) og hemmes av insulin. I tarmceller aktiveres ekspresjonen av genet for proglukagon av økte nivåer av cAMP og matinntak.
Produktet som kommer fra ekspresjonen av dette genet blir prosessert posttranslasjonalt i de enteroendokrine L-cellene (i tynntarmen), noe som ikke bare resulterer i frigjøring av glukagon-lignende peptid 1, men også i andre noe ukjente faktorer som glicentin, oxyintomodulin, glukagon-lignende peptid 2, etc..
Produksjon og action
Inntak av matvarer, spesielt de som er rike på fett og karbohydrater, stimulerer utskillelsen av GLP-1-peptidet fra intestinale enteroendokrine L-celler (nervestimulering eller stimulering formidlet av mange andre faktorer kan også forekomme).
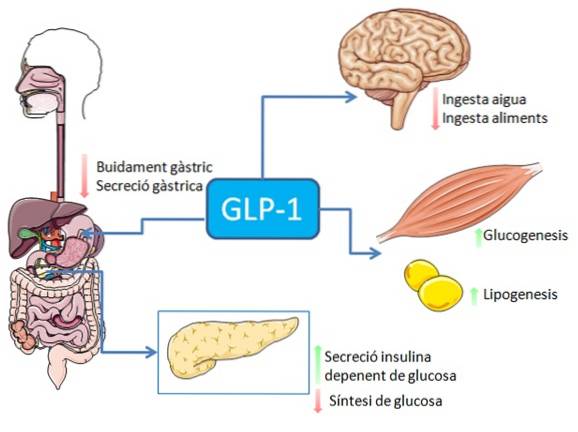
Hos mennesker og gnagere frigjøres dette peptidet i blodet i to faser: 10-15 minutter etter inntak og 30-60 minutter senere. Den aktive levetiden til dette hormonet i blodet er mindre enn 2 minutter, da det inaktiveres raskt proteolytisk av enzymet dipeptidylpeptidase-4 (DPP-4).
GLP-1 binder seg til en spesifikk membranreseptor (GLP-1R) på forskjellige celler i kroppen, inkludert noen av de endokrine cellene i bukspyttkjertelen, der den stimulerer glukoseavhengig insulinsekresjon.
Hvordan?
Binding av GLP-1 til reseptoren på betaceller i bukspyttkjertelen aktiverer produksjonen av cAMP mediert av adenylatsyklase i disse cellene. Det er en direkte inhibering av ATP-avhengige kaliumkanaler, som depolariserer cellemembranen.
Deretter øker intracellulært kalsiumnivå, noe som er resultatet av GLP-1-avhengig tilstrømning av ekstracellulært kalsium gjennom spenningsavhengige kalsiumkanaler, aktivering av ikke-selektive kationkanaler og mobilisering av kalsiumreserver..
Det øker også mitokondrie ATP-syntese, som favoriserer depolarisering. Senere stenges de spenningsstyrte kaliumkanalene, og forhindrer repolarisering av betacellene, og til slutt forekommer eksocytose av insulinlagringskornene..
I mage-tarmsystemet har binding av GLP-1 til reseptorene en hemmende effekt på magesyresekresjon og gastrisk tømming, noe som demper økningen i blodsukkernivået assosiert med matinntak..
Referanser
- Baggio, L. L., og Drucker, D. J. (2007). Biologi av inkretiner: GLP-1 og GIP. Gastroenterology, 132 (6), 2131-2157.
- Deacon, C. F., og Ahrén, B. (2011). Fysiologi av inkretiner i helse og sykdom. Gjennomgang av diabetiske studier: RDS, 8 (3), 293.
- Grossman, S. (2009). Differensiere inkretinterapier basert på strukturaktivitet og metabolisme: fokus på liraglutid. Farmakoterapi: Journal of Human Pharmacology and Drug Therapy, 29 (12P2), 25S-32S.
- Kim, W., & Egan, J. M. (2008). Rollen til inkretiner i glukosehomeostase og diabetesbehandling. Farmakologiske vurderinger, 60 (4), 470-512.
- Nauck, M. A., & Meier, J. J. (2018). Inkretinhormoner: deres rolle i helse og sykdom. Diabetes, fedme og metabolisme, 20, 5-21.
- Rehfeld, J. F. (2018). Opprinnelsen og forståelsen av inkretinkonseptet. Grenser i endokrinologi, 9.
- Vilsbøll, T., & Holst, J. J. (2004). Incretiner, insulinsekresjon og type 2 diabetes mellitus. Diabetologia, 47 (3), 357-366



Ingen har kommentert denne artikkelen ennå.