
Isomerisme
Hva er isomerisme?
Isomerisme er et kjemisk fenomen karakterisert ved at molekyler med samme antall atomer har forskjellige kjemiske eller fysiske egenskaper. Dermed forekommer det i isomerer, som igjen er molekyler hvis kjemiske formler er de samme, men deres strukturer eller romlige ordninger skiller seg vesentlig fra hverandre..
Vi har konstitusjonell eller strukturell isomerisme, og romlig isomerisme, som konsentrerer mye oppmerksomhet om stereokjemi. Flytskjemaet i bildet nedenfor viser at isomerer hovedsakelig er delt inn i de to typene isomerisme som nettopp er nevnt: konstitusjonelle og stereoisomerer..
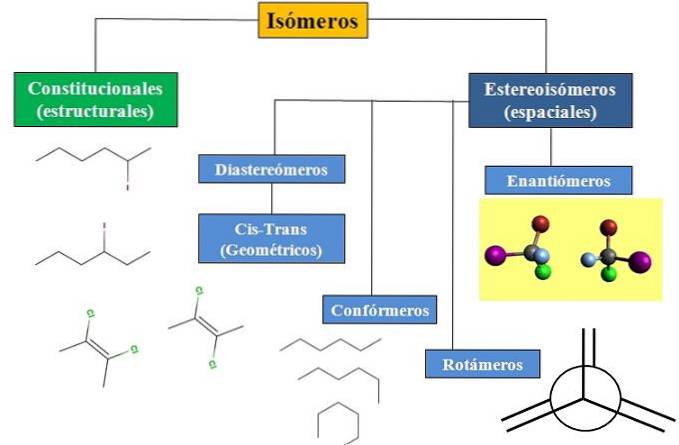
Alle isomerer, for en bestemt forbindelse, har den samme kjemiske formelen. Men strukturene som disse atomene kan bygge og deres proporsjoner er unike for hvert molekyl eller isomer. Selv om selve strukturen er den samme, kan atomene eller gruppene oppta forskjellige romlige posisjoner..
Flytskjemaet viser noen eksempler på isomerer som vil bli diskutert i de neste avsnittene..
Typer av isomerer
Konstitusjonell
Konstitusjonelle eller strukturelle isomerer er de som avviker i rekkefølgen av den molekylære ryggraden. Det vil si atomene deres ikke er koblet på samme måte, så strukturen eller funksjonsgruppene det er snakk om kan bli veldig forskjellige..
For eksempel for den samme kjemiske formelen C7H10Eller det kan være flere molekyler som oppfyller det antallet atomer; de vil alle ha et enkelt oksygenatom, men det strukturelle arrangementet til de andre atomene vil være unikt for hver isomer.
Og derav de kjemiske og fysiske egenskapene til alle konstitusjonelle isomerer for formel C7H10Eller de vil også være veldig forskjellige fra hverandre.
På den annen side kan konstitusjonelle isomerer være veldig enkle, og varierer bare i den relative posisjonen til et enkelt atom eller en gruppe. I neste avsnitt vil du se et eksempel på dette og det ovennevnte.
Stereoisomerer
Stereoisomerer er de som har samme strukturelle rekkefølge, men som er forskjellige i posisjonene og den romlige orienteringen til deres atomer eller grupper..
For at deres eksistens skal være mulig, må molekyler inneholde stereogene sentre, de mest kjente innen organisk kjemi er asymmetriske eller chirale karbonatomer; det vil si med fire forskjellige substituenter.
I tillegg til asymmetriske karbon, må det vurderte molekylet mangle elementer av symmetri. Ellers er det umulig for den romlige ordenen å bli stereoisomerisme..
Enantiomerer
Enantiomerer er stereoisomerer som består av ikke-overlappende speilbilder. For eksempel overlapper ikke høyre og venstre hender, det samme er sko eller hansker. Den neste delen vil ta for seg det klassiske eksemplet på enantiomerisme: bromklordometan: CBrClI.
Diastereomerer
Diastereomerer er derimot også stereoisomerer, men de er ikke speilbilder. Det vil si at det å plassere den ene foran den andre ikke er refleksjonen av seg selv. Av de mest kjente diastereomerer har vi cis-trans-isomerismen, også kalt geometrisk isomerisme, spesielt når den brukes på alkener.
Tilpassere
Tilformere, selv om de er innenfor stereoisomerismens spektrum, er egentlig ikke isomerer. De er romlige konfigurasjoner som et molekyl, i et bestemt øyeblikk eller energitilstand, får gjennom rotasjonene til flere av sine bindinger. Vi vil i neste avsnitt se eksemplet på konformitetene til n-heksan.
Rotamere
Til slutt har vi rotamerer, som ligner konformere i den forstand at de er avhengige av rotasjonen av kovalente bindinger..
Imidlertid blir en enkeltbinding mellom to karbonatomer tatt som referanse, og de relative posisjonene, enten formørket eller vekslet, av substituentene for begge karbonene blir sammenlignet. Senere vil vi se eksemplet på propylenrotamere.
Eksempler på isomerer
Heksanjod
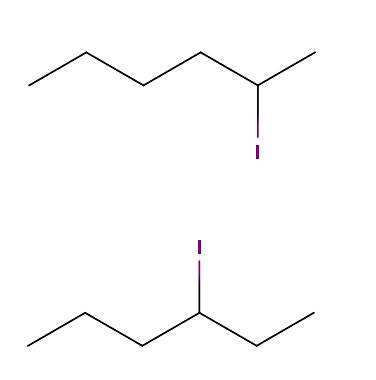
Ovenfor har vi to molekyler hvis kjemiske formler er C6H1. 3I. I den første har vi 2-jodheksan, mens den andre har 3-jodheksan. De er konstitusjonelle isomerer av posisjonell type, siden skjelettet er det samme, med den forskjellen at posisjonen til jodatomet varierer fra ett karbon til et annet..
C3H8ELLER
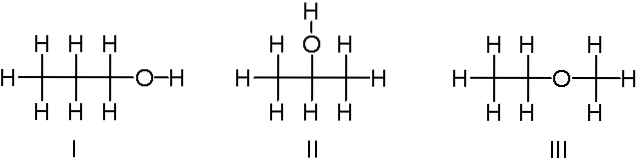
Ovenfor har vi et annet eksempel på konstitusjonelle isomerer for den kjemiske formelen C3H8O. Molekyler I og II er henholdsvis 1-propanol og 2-propanol. De er begge alkoholer. I stedet handler molekyl III om etylmetyleter.
Derfor snakker vi om en annen funksjonell gruppe. Merk at de tre molekylene har samme antall atomer, men strukturene deres er forskjellige..
2,3-diklor-2-buten
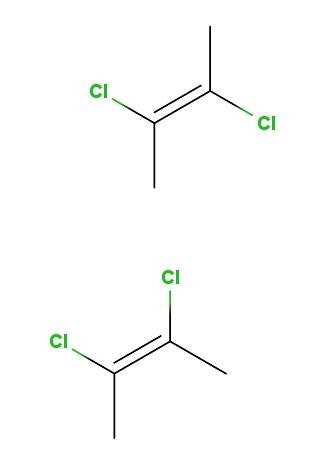
Ovenfor har vi trans-2,3-diklor-2-buten-isomeren, og under har vi cis-2,3-diklor-2-buten-isomeren. I den første er kloratomene i motsatte posisjoner med hensyn til dobbeltbindingen, mens de i den andre ligger på samme side av dobbeltbindingen..
Ryggraden for begge molekyler er den samme, men de varierer i kloratomens romlige posisjon; derfor er de stereoisomerer, og siden de ikke er speilbilder, blir de diastereomerer.
3-fluor-2-metylcykloheksan
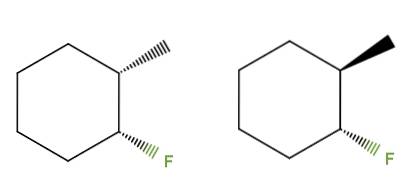
Denne gangen, i stedet for en dobbeltbinding, har vi en cykloheksanring for forbindelsen 3-fluor-2-metylcykloheksan. I venstre isomer grupperer CH3 og F er under ringens plan; mens i den til høyre, CH3 er oppe og F er nede.
Derfor vil den til venstre svare til cis-isomeren, og den til høyre være trans-isomeren. De er derfor diastereomerer, fordi de igjen ikke er speilbilder.
Overholdere av n-heksan
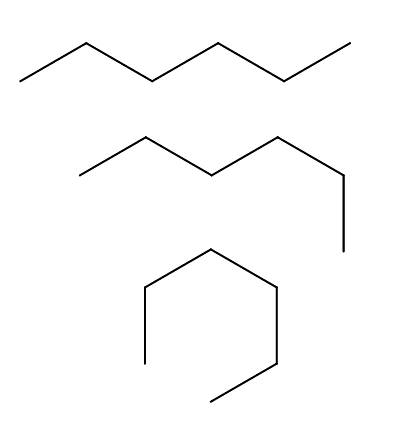
Vi har over tre samsvar med n-heksan, som skyldes rotasjoner og "bøyninger" av karbonkjeden i forskjellige retninger. De tilsvarer alle det samme molekylet av n-heksan med forskjellige nivåer av folding, som vil avhenge av miljøet og den indre energien til hvert molekyl.
3-brom-2-pentanol
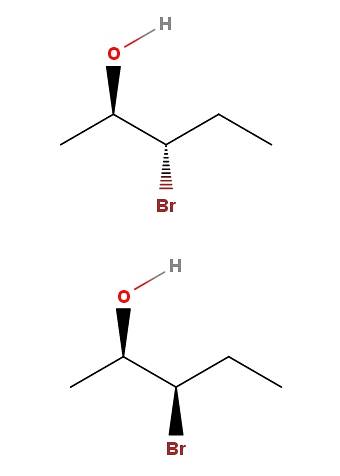
I 3-brom-2-pentanol har vi et annet eksempel på et par diastereomerer. Merk at igjen, i isomeren ovenfor, har vi OH og Br som peker i motsatt retning av skjelettplanet; mens i den nedre isomeren peker begge gruppene mot leserens retning.
1-brom-3-klor-5-etylcykloheksan
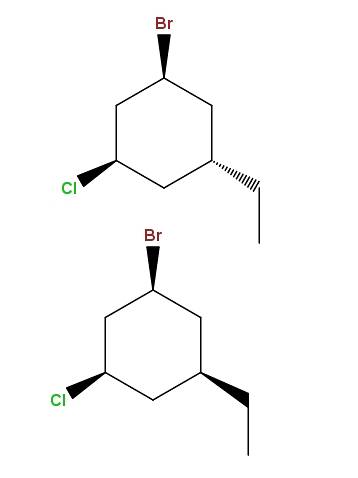
Og nok en gang har vi et annet par diastereomerer, med den forskjellen at nå ligger forskjellen i den romlige posisjonen til en enkelt gruppe: etylen, -CHtoCH3.
Denne typen isomerer har et veldig spesifikt navn: epimerer, som er diastereomerer hvis variasjon bare observeres i den romlige konfigurasjonen av et enkelt asymmetrisk karbon; i dette tilfellet, den som er bundet til -CHtoCH3.
Bromkloroyodometan
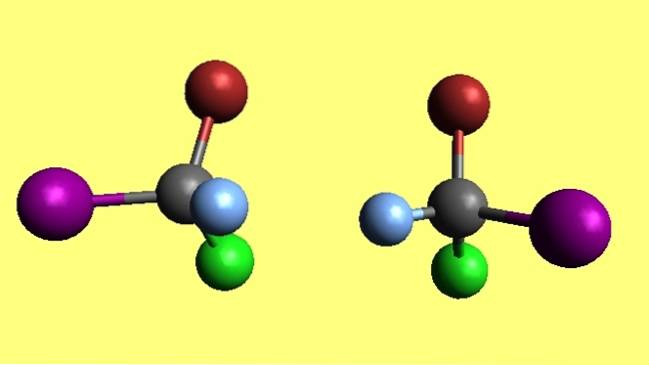
Merk at de to bromkloriodometanmolekylene, CBrClI, er enantiomerer fordi den ene er den ikke-overlagrede refleksjonen til den andre. Uansett hvor hardt du prøver, vil de fire atomer aldri matche. De sies å ha motsatte romlige konfigurasjoner.
2-brom-4-etylcykloheksan
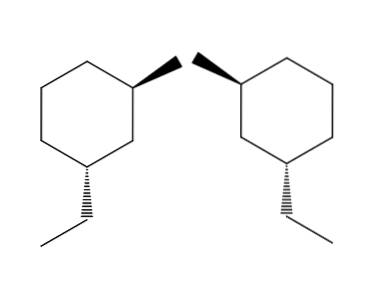
I eksemplet med 2-brom-4-etylcykloheksan-paret av molekyler er enantiomerismen enda tydeligere. Hvis vi prøver å snu molekylet til høyre, vil vi se at -CH-gruppentoCH3 den vil ikke være plassert under ringen, men over.
Tilsvarende CH3 Det peker ikke opp ringen, men under den. Romlige konfigurasjoner er omvendt, de er motsatte. Dette er en av de viktigste egenskapene til enatiomerisme..
Propylen rotamere
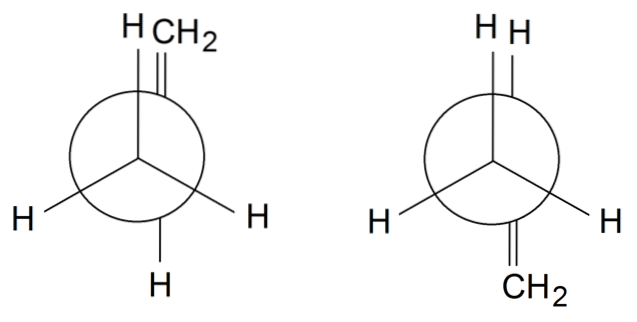
For å fullføre roterer vi propylenrotamere enkeltbindingen mellom C1 og Cto: H3C-CH = CHto. Gruppen = CHto er i formørket stilling med en av H-ene i CH-gruppen3 foran på rotameteret til venstre. I mellomtiden er = CHto og H er i alternative posisjoner på høyre rotamer.
Avhengig av formørkelsen eller ikke av gruppene, vil vi ha sterisk hindring, som vil destabilisere rotameren. Derfor er rotameren til høyre mer stabil enn den til venstre..
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Dr. S. Gevorg. (2020). Enantiomerer, diastereomerer, identiske eller konstitusjonelle isomerer. Kjemiske trinn. Gjenopprettet fra: chemistrysteps.com
- Wikipedia. (2020). Isomer. Gjenopprettet fra: en.wikipedia.org
- Allison Soult. (13. august 2020). Isomerer. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- James Ashenhurst. (2020). Stereokjemi og kiralitet. Gjenopprettet fra: masterorganicchemistry.com



Ingen har kommentert denne artikkelen ennå.