
De 7 egenskapene til de viktigste væskene

De egenskaper av væsker tjener til å definere den molekylære strukturen og de fysiske egenskapene til en av tilstandene i materien.
De mest studerte er kompressibilitet, overflatespenning, kohesjon, vedheft, viskositet, frysepunkt og fordampning..

Væske er en av de tre tilstandene for aggregering av materie, de to andre er faste og gassformige. Det er en fjerde tilstand av materie, plasma, men den forekommer bare under forhold med ekstremt trykk og temperaturer..
Tørrstoffer er stoffer som opprettholder sin form som de lett kan identifiseres som gjenstander med. Gasser er stoffer som finnes flytende i luften og er spredt i den, men de kan bli fanget i beholdere som bobler og ballonger..
Væsker er midt i faste og gassformige tilstander. Generelt, ved å utøve endringer i temperatur og / eller trykk, er det mulig å få en væske til å passere inn i en av de to andre tilstandene.
Det er et stort antall flytende stoffer til stede på planeten vår. Disse inkluderer oljete væsker, organiske og uorganiske væsker, plast og metaller som kvikksølv. Hvis du har forskjellige typer molekyler av forskjellige materialer oppløst i en væske, kalles det en løsning, som honning, kroppsvæsker, alkohol og fysiologisk saltvann..
Hovedtrekk ved flytende tilstand
1- Kompressibilitet
Det begrensede rommet mellom partiklene gjør væsker til et nesten ukomprimerbart stoff. Det vil si at det er veldig vanskelig å presse for å tvinge en viss mengde væske i et veldig lite rom for volumet.
Mange støtdempere i biler eller store lastebiler bruker væsker under trykk, for eksempel oljer, i forseglede rør. Dette hjelper til med å absorbere og motvirke den stadige kjasingen som sporet utøver på hjulene, og søker den minste overføring av bevegelse til kjøretøystrukturen..
2- Statlige endringer
Hvis du utsetter en væske for høye temperaturer, vil den fordampe. Dette kritiske punktet kalles kokepunktet og er forskjellig avhengig av stoffet. Varmen øker skillet mellom væskemolekylene til de skiller seg nok til å spre seg som en gass.
Eksempler: vann fordamper ved 100 ° C, melk ved 100,17 ° C, alkohol ved 78 ° C og kvikksølv ved 357 ° C.
I motsatt tilfelle vil eksponering av en væske for veldig lave temperaturer føre til at den stivner. Dette kalles frysepunktet, og det vil også avhenge av tettheten til hvert stoff. Kulde bremser atomernes bevegelse, og øker deres intermolekylære tiltrekning nok til å stivne til en solid tilstand..
Eksempler: vann fryser ved 0 ° C, melk mellom -0,513 ° C og -0,565 ° C, alkohol ved -114 ° C og kvikksølv ved omtrent -39 ° C.
Det skal bemerkes at å senke temperaturen til en gass til den blir en væske kalles kondens, og ved å varme opp et fast stoff tilstrekkelig kan det smeltes eller smeltes til flytende tilstand. Denne prosessen kalles fusjon. Vannkretsløpet forklarer perfekt alle disse prosessene med tilstandsendringer.
3- Samhold
Det er tendensen til den samme typen partikler å tiltrekke hverandre. Denne intermolekylære tiltrekningen i væsker gjør at de kan bevege seg og strømme, og holde seg sammen til de finner en måte å maksimere denne attraktive kraften på..
Samhold betyr bokstavelig talt "handling for å holde sammen." Under væskeoverflaten er kohesjonskraften mellom molekylene den samme i alle retninger. Imidlertid har molekylene på overflaten bare denne tiltrekningskraften mot sidene og spesielt mot det indre av væsken..
Denne eiendommen er ansvarlig for at væsker danner kuler, som er den formen som har minst overflateareal for å maksimere intermolekylær tiltrekning..
Under null-tyngdekraftsforhold vil væsken flyte i en sfære, men når sfæren trekkes av tyngdekraften, skaper de den velkjente dråpeformen i et forsøk på å holde seg fast sammen..
Effekten av denne egenskapen kan forstås med dråper på flate overflater; partiklene er ikke spredt av kohesjonskraften. Også i lukkede kraner med sakte drypp; den intermolekylære tiltrekningen holder dem sammen til de blir veldig tunge, det vil si når vekten overstiger væskens sammenhengende kraft, faller den ganske enkelt.
4- Overflatespenning
Kohesjonskraften på overflaten er ansvarlig for dannelsen av et tynt lag med partikler som er mye mer tiltrukket av hverandre enn for de forskjellige partiklene rundt dem, for eksempel luft..
Væskens molekyler vil alltid søke å minimere overflatearealet ved å tiltrekke seg mot innsiden, noe som gir følelsen av å ha en beskyttende hud..
Så lenge denne attraksjonen ikke blir forstyrret, kan overflaten være utrolig sterk. Denne overflatespenningen tillater, i tilfelle vann, at visse insekter glir og holder seg på væsken uten å synke.
Det er mulig å holde flate faste gjenstander på væske hvis man søker å forstyrre overflatemolekylenes tiltrekning så lite som mulig. Det oppnås ved å fordele vekten over gjenstandens lengde og bredde for ikke å overskride kohesjonskraften.
Samholdskraften og overflatespenningen er forskjellig avhengig av væsketype og densitet..
5- Tilslutning
Det er tiltrekningskraften mellom forskjellige typer partikler; som navnet antyder, betyr det bokstavelig talt "tilslutning". I dette tilfellet er det vanligvis tilstede på veggene til væskebeholderbeholdere og i områdene der det strømmer..
Denne eiendommen er ansvarlig for væske som fukter faste stoffer. Det oppstår når adhesjonskraften mellom molekylene i væsken og det faste stoffet er større enn den intermolekylære kohesjonskraften til den rene væsken.
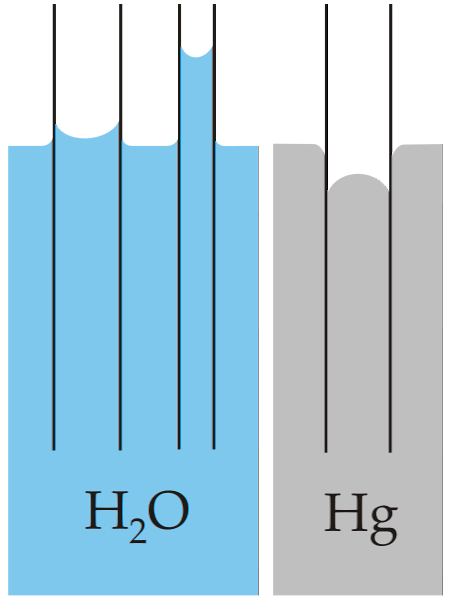
6- Kapillaritet
Vedheftskraften er ansvarlig for vekst eller fall av væsker når det fysisk samhandler med et fast stoff. Denne kapillærvirkningen kan påvises i beholdernes faste vegger, siden væsken har en tendens til å danne en kurve som kalles menisken..
Større vedheftningskraft og mindre kohesjonskraft, menisken er konkav, og ellers er menisken konveks. Vann vil alltid kurve oppover der det kommer i kontakt med en vegg og kvikksølv vil kurve nedover; atferd som er nesten unik i dette materialet.
Denne egenskapen forklarer hvorfor mange væsker stiger når de samhandler med veldig smale hule gjenstander som sugerør eller rør. Jo smalere diameteren på sylinderen er, vedheftningskraften til veggene vil føre til at væsken kommer inn i beholderens indre nesten umiddelbart, selv mot tyngdekraften..
7- Viskositet
Det er den indre kraften eller motstanden mot deformasjon som tilbys av en væske når den flyter fritt. Det avhenger hovedsakelig av massen til de indre molekylene og den intermolekylære forbindelsen som tiltrekker dem. Langsommere flytende væsker sies å være mer tyktflytende enn lettere og raskere flytende væsker.
For eksempel: motorolje er mer tyktflytende enn bensin, honning er mer tyktflytende enn vann, og lønnesirup er mer tyktflytende enn vegetabilsk olje..
For at en væske skal strømme, trenger den påføring av en kraft; for eksempel tyngdekraften. Men det er mulig å redusere viskositeten til stoffer ved å påføre varme. Økningen i temperatur gjør at partiklene beveger seg raskere slik at væsken strømmer lettere.
Flere fakta om væsker
Som i partiklene av faste stoffer er væskens gjenstand for en permanent intermolekylær tiltrekning. Imidlertid, i væsker er det mer plass mellom molekylene, dette gjør at de kan bevege seg og strømme uten å forbli i en fast posisjon..
Denne tiltrekningen holder volumet av væsken konstant, nok til at molekylene holdes sammen av tyngdekraften uten å spre seg i luften som i tilfelle gasser, men ikke nok til å holde den i en definert form som i tilfellet med gasser. tilfelle av faste stoffer.
På denne måten vil en væske søke å strømme og gli fra høye nivåer for å omfatte den laveste delen av en beholder, og dermed ta form, men uten å endre volumet. Væskenes overflate er vanligvis flat takket være tyngdekraften som presser på molekylene.
Alle disse beskrivelsene nevnt ovenfor er vitne til i hverdagen hver gang reagensglass, tallerkener, kopper, kolber, flasker, vaser, akvarier, tanker, brønner, akvarier, rørsystemer, elver, innsjøer og demninger er fylt med vann..
Morsomme fakta om vann
Vann er den vanligste og rikeligste væsken på jorden, og det er et av de få stoffene som finnes i noen av de tre tilstandene: det faste stoffet i form av is, dets normale flytende tilstand og det gassformige i form av damp . Vann.
- Det er den ikke-metalliske væsken med høyest kohesjonskraft.
- Det er den vanlige væsken med høyest overflatespenning bortsett fra kvikksølv.
- De fleste faste stoffer utvides når de smelter. Vann utvides når det fryser.
- Mange faste stoffer er tettere enn de tilsvarende flytende tilstandene. Is er mindre tett enn vann, og det er derfor den flyter.
- Det er et utmerket løsemiddel. Det kalles det universelle løsningsmidlet
Referanser
- Mary Bagley (2014). Egenskaper ved materie: væsker. Live Science. Gjenopprettet fra livescience.com.
- Satya Shetty. Hva er egenskapene til væske? Bevar artikler. Gjenopprettet fra preservearticles.com.
- University of waterloo. Den flytende staten. CAcT Hjemmeside. Det naturvitenskapelige fakultet. Gjenopprettet fra uwaterloo.ca.
- Michael Blaber (1996). Egenskaper av væsker: Viskositet og overflatespenning - Intermolekylære krefter. Florida State Universit - Institutt for biomedisinsk vitenskap. Gjenopprettet fra mikeblaber.org.
- Grupper for kjemisk utdanning. Væsker. Bodner forskningsnett. Purdue University - College of Science. Gjenopprettet fra chemed.chem.purdue.edu.
- Flytende grunnleggende. Andrew Rader Studios. Gjenopprettet fra chem4kids.com.
- Egenskaper av væsker. Institutt for kjemi og biokjemi. Florida State University, Tallahassee. Gjenopprettet fra chem.fsu.edu.
- Leksikon med eksempler (2017). Eksempler på fast, flytende og gassformig. Gjenopprettet fra eksempler.co.


Ingen har kommentert denne artikkelen ennå.