
Menisk (kjemi) hva den består av og typer
De menisk er krumningen på overflaten til en væske. Det er også den frie overflaten av en væske ved væske-luft-grensesnittet. Væsker er preget av å ha et fast volum, som er dårlig komprimerbart.
Imidlertid varierer væskens form ved å ta formen på beholderen som inneholder dem. Denne karakteristikken skyldes tilfeldig bevegelse av molekylene som danner dem..

Væsker har evnen til å strømme, høy tetthet og diffundere raskt inn i andre væsker som de er blandbare med. De opptar det laveste området av containeren etter tyngdekraften, og etterlater en ikke helt flat overflate øverst. I noen tilfeller kan de ta spesielle former som dråper, bobler og bobler..
Egenskapene til væsker som smeltepunkt, damptrykk, viskositet og fordampningsvarme, avhenger av intensiteten til de intermolekylære kreftene som gir væskene kohesjon..
Imidlertid samhandler væsker også med beholderen gjennom adhesjonskrefter. Menisken oppstår da fra disse fysiske fenomenene: forskjellen mellom kohesjonskreftene mellom væskepartiklene, og de vedheft som gjør at de kan fukte veggene..
Artikkelindeks
- 1 Hva er menisken?
- 1.1 Samholdskrefter
- 1.2 Adhesjonskrefter
- 2 typer menisk
- 2.1 Konkave
- 2.2 Konveks
- 3 Overflatespenning
- 4 Kapillaritet
- 5 Referanser
Hva er menisken?
Som nettopp forklart, er menisken et resultat av forskjellige fysiske fenomener, blant annet overflatespenningen til væsken kan også nevnes..
Samholdskrefter
Kohesjonskrefter er det fysiske begrepet som forklarer intermolekylære interaksjoner i væsken. Når det gjelder vann, skyldes kohesjonskreftene dipol-dipol-interaksjonen og hydrogenbindinger.
Vannmolekylet har bipolar karakter. Dette skyldes det faktum at oksygenet i molekylet er elektronegativt, da det har større aviditet for elektroner enn hydrogener, noe som bestemmer at oksygenet sitter igjen med en negativ ladning og at hydrogenene er positivt ladede..
Det er en elektrostatisk tiltrekning mellom den negative ladningen til et vannmolekyl, plassert på oksygen, og den positive ladningen til et annet vannmolekyl, som ligger på hydrogener..
Denne interaksjonen er det som er kjent som dipol-dipol-interaksjonen eller kraften, noe som bidrar til kohesjonen av væsken..
Adhesjonskrefter
På den annen side kan vannmolekyler samhandle med glassvegger ved delvis å lade hydrogenatomene i vannmolekylene som binder seg sterkt til oksygenatomene på overflaten av glasset..
Dette utgjør vedheftningskraften mellom væsken og den stive veggen; dagligdags sies det at væsken våter veggen.
Når en silikonløsning er plassert på overflaten av glasset, impregnerer ikke vannet glasset helt, men det dannes dråper på glasset som lett kan fjernes. Det er således antydet at ved denne behandlingen reduseres vedheftningskraften mellom vann og glass..
Et veldig lignende tilfelle oppstår når hendene er fete, og når de vaskes i vann, kan det sees veldig definerte dråper på huden i stedet for en fuktig hud.
Typer menisk
Det er to typer menisk: konkave og konvekse. På bildet er det konkave A og det konvekse B. De stiplede linjene indikerer riktig nivå når du leser en volummåling.
Konkave
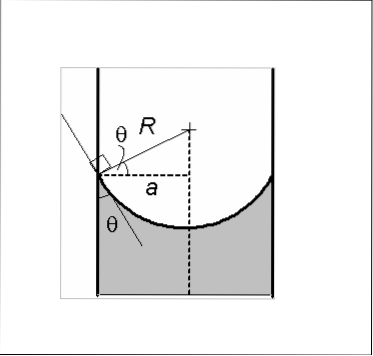
Den konkave menisken er preget av at kontaktvinkelen θ dannet av glassveggen med en linje som tangerer menisken og som føres inn i væsken, har en verdi mindre enn 90 °. Hvis en mengde væske plasseres på glasset, har den en tendens til å spre seg over glassets overflate..
Tilstedeværelsen av en konkav menisk viser at kohesjonskreftene i væsken er mindre enn væskeglassens vedheftningskraft.
Derfor bader eller fukter væsken glassveggen, holder på en mengde væske og gir menisken en konkav form. Vann er et eksempel på en væske som danner konkav menisci.
Konveks
Når det gjelder den konvekse menisken, har kontaktvinkelen θ en verdi større enn 90º. Kvikksølv er et eksempel på en væske som danner konvekse menisci. Når en dråpe kvikksølv plasseres på en glassflate, har kontaktvinkelen θ en verdi på 140º.
Observasjonen av en konveks menisk indikerer at væskens kohesjonskrefter er større enn adhesjonskraften mellom væsken og glassveggen. Det sies at væsken ikke våter glasset.
Overflatekreftene til kohesjon (væske-væske) og vedheft (væske-fast stoff) er ansvarlige for mange fenomener av biologisk interesse; slik er tilfellet med overflatespenning og kapillaritet.
Overflatespenning
Overflatespenning er en netto tiltrekningskraft som utøves på molekylene i væsken som er på overflaten, og som har en tendens til å introdusere dem i væsken..
Derfor har overflatespenningen en tendens til å samle væsken og gi dem mer konkave menisker; Eller på en annen måte: denne kraften har en tendens til å fjerne overflaten av væsken fra glassveggen.
Overflatespenningen har en tendens til å synke når temperaturen øker, for eksempel: overflatespenningen til vann er lik 0,076 N / m ved 0 ° C og 0,059 N / m ved 100 ° C.
I mellomtiden er overflatespenningen til kvikksølv ved 20 ºC 0,465 N / m. Dette vil forklare hvorfor kvikksølv former konvekse menisker.
Kapillaritet
Hvis kontaktvinkelen θ er mindre enn 90º, og væsken fukter glassveggen, kan væsken inne i glaskapillærene stige til en likevektstilstand.
Vekten av væskesøylen kompenseres av den vertikale komponenten av kohesjonskraften på grunn av overflatespenning. Adhesjonskraften griper ikke inn fordi de er vinkelrett på overflaten av røret.
Denne loven forklarer ikke hvordan vann kan stige fra røttene til bladene gjennom karene på xylem..
Egentlig er det andre faktorer som griper inn i denne forbindelse, for eksempel: når vannet fordamper i bladene, tillater det at vannmolekylene i den øvre delen av kapillærene suges opp.
Dette gjør at andre molekyler fra bunnen av kapillærene kan stige for å ta plass til de fordampede vannmolekylene..
Referanser
- Ganong, W. F. (2002). Medisinsk fysiologi. 2002. 19. utgave. Modern Manual Editorial.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Helmenstine, Anne Marie, Ph.D. (4. august 2018). Hvordan lese en menisk i kjemi. Gjenopprettet fra: thoughtco.com
- Wikipedia. (2018). Menisk (flytende). Gjenopprettet fra: en.wikipedia.org
- Friedl S. (2018). Hva er en menisk? Studere. Gjenopprettet fra: study.com
- Overflatespenning. Gjenopprettet fra: chem.purdue.edu


Ingen har kommentert denne artikkelen ennå.