
Myosinegenskaper, struktur, typer og funksjon
De myosin det er en molekylmotor, protein i naturen, i stand til å bevege seg på aktinfilamenter i cytosolen. Energien som driver forskyvningen av myosin kommer fra hydrolysen av ATP. På grunn av dette blir myosin ofte definert som et mekanokjemisk enzym.
I eukaryoter er myosin et veldig rikelig protein. Det er forskjellige klasser av myosin, som er kodet av en familie av gener. I gjær skilles 5 klasser ut, mens hos pattedyr er dusinvis blitt beskrevet.
Myosin har et bredt utvalg av funksjoner. Myosin I, sammen med aktin, deltar i bevegelsen av keratocytter.
Myosin II gir stivhet til plasmamembranen, deltar i cytokinese og muskelsammentrekning. Både myosiner I og II samarbeider med cellevandring. Myosiner I og V utfører vesikeltransport langs aktinfilamenter.
Artikkelindeks
- 1 Struktur
- 2 funksjoner
- 3 funksjoner
- 3.1 Muskelsammentrekning
- 3.2 Cytokinesis
- 3.3 Avstivning av kortikale membraner
- 3.4 Celleadhesjon
- 3.5 Forskyvning av noen vesikler
- 4 Sykdommer relatert til myosin
- 4.1 Myosiner og hørselstap
- 4.2 Myosin X og kreft
- 5 Referanser
Struktur
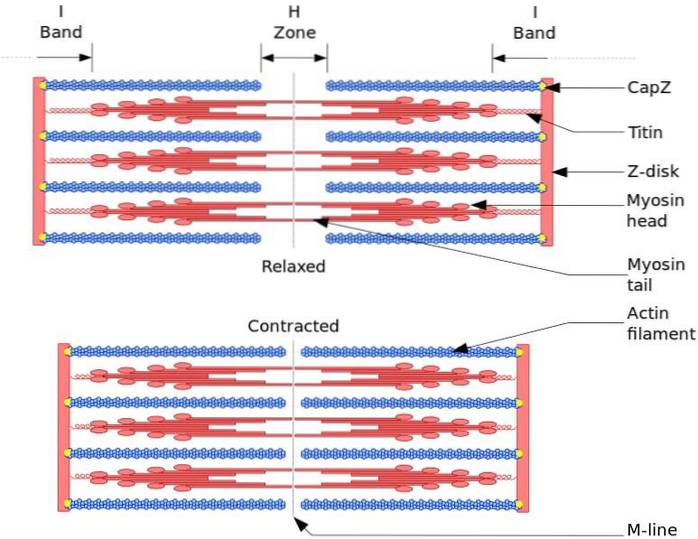
I elektronmikrofotografier har den typiske strukturen til myosin-isoformer tre domener: hode, nakke og hale. Ved hydrolyse med chymotrypsin oppnås et segment bestående av hode og nakke, kalt tung meromyosin (HMM), og et segment av halen, kalt lett meromyosin (LMM).
Hodedomenet er den N-terminale enden av den tunge kjeden, og haledomenet er den C-terminale enden av den lette kjeden.
Klassene av myosin kan skiller seg ut fra antall polypeptidkjeder som komponerer det, og overflod og klasse av lett kjede festet til nakken.
Myosin I har en polypeptidkjede som danner et hode og halen mangler alfa-spiralformede områder. Mens myosiner I og V har to polypeptidkjeder, og danner derfor to hoder og en hale, der de spiralformede alfakjedene vikles for å danne en stavlignende struktur.
Myosiner I og V har bindingssteder for calmodulin, som regulerer og binder Ca+to, på lette kjeder. Myosin jeg fikser Ca+to i lette kjeder, men gjør det annerledes enn kalmodulin.
Kjennetegn
På mekanokjemisk nivå har myosiner tre egenskaper, nemlig:
- Myosinhodet er det motoriske domenet som går fremover i diskrete trinn: Myosinhodets forening til et aktinfilament, dets tilbøyelighet og påfølgende separasjon produserer myosinets bevegelse. Denne prosessen er syklisk og avhenger av ATP.
- Konformale endringer: hydrolysen av et ATP-molekyl er koblet til hvert trinn i et myosinmolekyl, gjennom nivåer av amplifikasjon og overføring. Dette innebærer store konformasjonsendringer av myosin..
Det første nivået av amplifikasjon produseres ved tap av gamma-fosfatgruppen av ATP, som tillater en omorganisering av strukturelementene i ATP-bindingsstedet. Denne omorganiseringen er koordinert med strukturelle endringer i det aktinbindende stedet..
Det andre forsterkningsnivået involverer kommunikasjon av konformasjonsendringen i det aktive stedet til strukturelle komponenter i karboksylterminalen..
- Retningsbestemmelse: Myosiner har vist seg å ha polaritet, eller omvendt retningsretning, mot (+) enden av aktinfilamentet. Denne konklusjonen kommer fra actin filament slip eksperimenter, ved hjelp av fluorescens lysmikroskop..
Funksjoner
Myosin, sammen med aktin, deltar i muskelsammentrekning, celleheft, cytokinese, avstivning av kortikale membraner og forskyvning av noen vesikler, blant andre funksjoner..
Defekter i myosin kan gi patologiske forhold. For eksempel er defekter i myosiner I og V relatert til henholdsvis myosin myopatier og pigmenteringsforstyrrelser (Griscelli syndrom). Mens forstyrrelser i myosin VI isoformer forårsaker hørselstap.
Muskelsammentrekning
Den funksjonelle og strukturelle enheten til skjelettmuskulaturen er sarkomeren. Under muskelsammentrekning når sarkomeren 30% av den opprinnelige lengden.
Sarkomerer består av tykke myosinfilamenter og tynne aktinfilamenter som er organisert på en kompleks måte. Generelt er myosinhodene plassert i de fjerne endene av filamentet og halene mot sentrum av sarkomeren, og organisasjonen er bipolar.
For at muskelsammentrekning skal skje, må myosinhodene i motsatte ender bevege seg mot Z-skiven eller (+) enden av filamentet. Fordi organiseringen av de tykke filamentene er bipolar, skjer glidningen av de tynne filamentene på de tykke filamentene, drevet av ATP.
Forskyvningskraften oppstår fordi hundrevis av myosinhoder, av tykt filament, samhandler med et tynt filament.
Cytokinesis
Under mitose, når mikrotubuli ved spindelpolene skilles ut, danner actin og myosin II en kontraktil ring ved ekvator i cellen. Denne ringen trekker seg sammen, reduserer diameteren og deler cellen i to deler..
Avstivning av kortikale membraner
I mutante celler som mangler myosin II, deformeres plasmamembranen lett når en ekstern kraft påføres. Dette skjer fordi myosin II gir aggregeringskraft til plasmamembranproteiner..
Celleadhesjon
I epitelvev er de kontraktile bunter av aktin og myosin II lokalisert i nærheten av plasmamembranen, og danner en sirkulær belte som omgir den indre celleoverflaten. Denne sirkelbåndet bestemmer celleformen og opprettholder båndet mellom cellene..
Kontakten mellom celler skjer ved forening av det sirkulære beltet til de cellulære adhesjonsmolekylene, ved hjelp av foreningsproteiner.
Forskyvning av noen vesikler
Eksperimentell bevis avslører at myosin V utfører membrantransport fra Golgi-apparatet til periferien av cellen. Noen bevis er:
- I nervøse vevsceller ble det ved astrocyttimmunfluorescens funnet at myosin V ligger ved siden av Golgi.
- I gjær forstyrrer mutasjoner i myosin V-genet proteinutskillelsen og følgelig akkumuleres protein i cytosolen.
- Myosin I-isoformene er ansvarlige for transport av vakuoler mot cellemembranen. Ved å bruke spesifikke antistoffer mot myosin I-isoformer, ble det funnet at disse isoformene er lokalisert i forskjellige deler av cellen..
For eksempel når en levende amøbe er merket med et antistoff mot myosin IC, stoppes transporten av vakuolen til membranen. På grunn av dette utvides vakuolen og cellen sprekker.
Myosin-relaterte sykdommer
Myosiner og hørselstap
Det er mange gener og mutasjoner som forårsaker hørselstap. Denne sykdommen er ofte monogenetisk .
Ukonvensjonelle myosinmutasjoner med ett eller to myosinhoder påvirker funksjonen til det indre øret. Noen av de muterte myosin-isoformene er myosin IIIA, myosin VIIA og myosin XVA. Nylig ble det oppdaget to mutasjoner i myosin VI.
Mutasjoner i myosin VI er c.897G> T og s.926Q. Den første mutasjonen påvirker en region som samhandler med det aktive stedet, kalt Switch I. Homozygot for mutasjonen viser fenotypen tidlig og forårsaker alvorlige effekter.
Den andre mutasjonen påvirker et område med ladede rester, i en alfa-helix i halen til myosin VI. Denne regionen er viktig for proksimal dimerisering av motoren, og påvirker stereo-ciliærfunksjonen til myosin VI..
En annen mutasjon er p.Asn207Ser, som produserer en motor som ikke er i stand til å produsere kraft. Dette er fordi Asn 207 er en aminosyrerest fra det aktive stedet, hvis funksjon er binding og hydrolyse av ATP.
P.Arg657Trp-mutasjonen forårsaker tap av myosin VI-funksjon. Arg-resten er involvert i konformasjonsendringene som kobler hydrolyse til bevegelsen av myosin.
Myosin X og kreft
Myosin X (Myo10) er et ukonvensjonelt myosin som uttrykkes i hjernen, endotel og mange epitelier. Myo10 og tre klasser av aktinbaserte projeksjoner (filopodia, invadopodia og filopodia-lignende anslag) fungerer under kreftmetastase.
Invasive kreftceller har et stort antall filopodia og uttrykker høye nivåer av fascina. Dette proteinet lager tverrbindinger mellom aktinfilamenter. For å unnslippe den primære svulsten dannes invadopodia, rik på proteolytisk aktivitet, som fordøyer den omkringliggende ekstracellulære matrisen..
Når cellene når den ekstracellulære matrisen, hjelper filopodia-lignende anslag til å spre seg og kolonisere. Høye nivåer av Myo10 indikerer høy aggressivitet og metastase ved brystkreft.
MyoX-lyddemping forårsaker tap av metastatisk karakter av celler, som ikke klarer å danne aktinbaserte projeksjoner. Alle disse anslagene har integrinbaserte vedheft, som bæres av Myo10 i filopodium..
MyoX er involvert i dannelsen av sentrosomet. Fraværet av MyoX favoriserer dannelsen av multipolare spindler. MyoX er også involvert i signalisering i kreftceller. For eksempel aktiveres MyoX av 3,4,5, -inositoltrifosfat (PIP3).
Referanser
- Alberts, B., Johnson, A., Lewis, J., et al. 2007. Molecular Biology of the Cell. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, A., Karfunkel-Doron, D., Sirigu, S., Davido, B., Shohat, M., Frydman, M., Houdusse, A., Kanaan, M., Avraham , K. 2014. Nye myosinmutasjoner for arvelig hørselstap avslørt av målrettet genomfangst og massivt parallell sekvensering. European Journal of Human Genetics, 22: 768-775.
- Courson, D.S. og Cheney, R.E. 2015. Myosin-X og sykdom. Eksperimentell celleforskning, 334: 10-15.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Cellular and molecular biology. Redaksjonell Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, São Paulo.
- Schliwa, M. og Woehlke, G. 2003. Molekylære motorer. Nature, 422: 759-765.
- OK, R.D. 2003. Molecular Motor Toolbox for Intracellular Transport. Cell, 112: 467- 480.


Ingen har kommentert denne artikkelen ennå.