
Schrödinger Atomic Model Characteristics, Postulates

De Schrödingers atommodell ble utviklet av Erwin Schrödinger i 1926. Dette forslaget er kjent som den kvantemekaniske modellen for atomet, og beskriver elektronens bølgefunksjon..

Schrödinger foreslo at bevegelsen til elektronene i atomet tilsvarte bølgepartikkel-dualiteten, og følgelig kunne elektronene bevege seg rundt kjernen som stående bølger..
Schrödinger, som ble tildelt Nobelprisen i 1933 for sine bidrag til atomteorien, utviklet ligningen med samme navn for å beregne sannsynligheten for at et elektron er i en bestemt posisjon.
Artikkelindeks
- 1 Kjennetegn på Schrödingers atommodell
- 2 eksperiment
- 2.1 Youngs eksperiment: den første demonstrasjonen av bølge-partikkel dualitet
- 2.2 Schrödinger-ligningen
- 3 Postulater
- 4 Artikler av interesse
- 5 Referanser
Kjennetegn ved atommodellen til Schrödinger
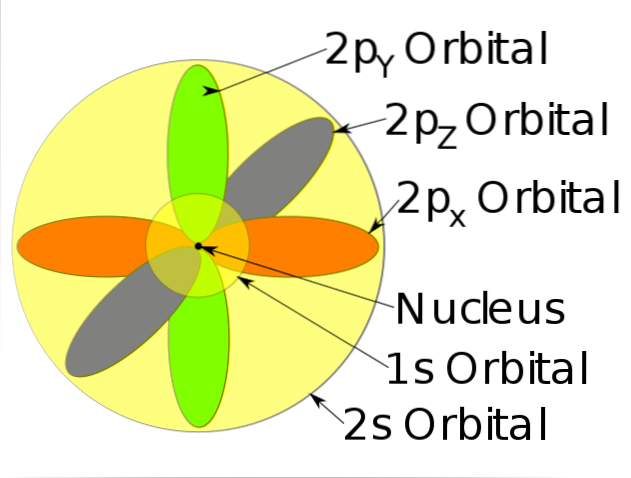
-Beskriv bevegelsen til elektroner som stående bølger.
-Elektroner beveger seg konstant, det vil si at de ikke har en fast eller definert posisjon i atomet.
-Denne modellen forutsier ikke plasseringen av elektronet, og den beskriver heller ikke veien den tar innenfor atomet. Bare opprett en sannsynlighetssone for å finne elektronet.
-Disse sannsynlighetsområdene kalles atomorbitaler. Orbitalene beskriver en translasjonsbevegelse rundt atomkjernen.
-Disse atomorbitalene har forskjellige energinivåer og undernivåer, og kan defineres mellom elektronskyer.
-Modellen vurderer ikke kjernens stabilitet, den refererer bare til å forklare kvantemekanikken assosiert med bevegelsen av elektroner i atomet..

Eksperiment
Schrödingers atommodell er basert på Broglie-hypotesen, samt på de tidligere atommodellene til Bohr og Sommerfeld.
Broglie foreslo at akkurat som bølger har egenskaper av partikler, har partikler egenskaper av bølger, med tilhørende bølgelengde. Noe som genererte mye forventning på den tiden, da han var Albert Einstein selv som støttet teorien sin.
Imidlertid hadde de Broglie-teorien en mangel, som var at meningen med selve ideen ikke var godt forstått: et elektron kan være en bølge, men av hva? Det er da figuren til Schrödinger ser ut til å gi et svar.
For å gjøre dette, stolte den østerrikske fysikeren på Youngs eksperiment, og basert på sine egne observasjoner utviklet han det matematiske uttrykket som bærer hans navn.
Her er de vitenskapelige grunnlagene for denne atommodellen:
Youngs eksperiment: den første demonstrasjonen av bølge-partikkel dualitet
De Broglie-hypotesen om materiens undulerende og korpuskulære natur kan demonstreres ved hjelp av Youngs eksperiment, også kjent som dobbeltspalt-eksperimentet..
Den engelske vitenskapsmannen Thomas Young la grunnlaget for Schrödingers atommodell da han i 1801 utførte eksperimentet for å verifisere lysets bølgenatur.
Under eksperimenteringen delte Young utstrålingen av en lysstråle som passerte gjennom et lite hull gjennom et observasjonskammer. Denne inndelingen oppnås ved å bruke et 0,2 millimeter kort, plassert parallelt med strålen..
Utformingen av eksperimentet ble laget slik at lysstrålen var bredere enn kortet. Dermed ble strålen delt i to omtrent like store deler når kortet ble plassert horisontalt. Lysstrålene ble sendt av et speil.
Begge lysstrålene traff en vegg i et mørkt rom. Der ble interferensmønsteret mellom de to bølgene påvist, noe som viste at lys kunne oppføre seg både som en partikkel og som en bølge..
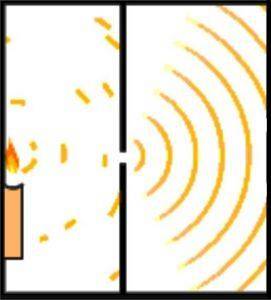
Et århundre senere forsterket Albert Einsten ideen ved hjelp av prinsippene for kvantemekanikk..
Schrödinger-ligningen
Schrödinger utviklet to matematiske modeller, som skiller hva som skjer avhengig av om kvantetilstanden endres med tiden eller ikke.
For atomanalyse publiserte Schrödinger den tidsuavhengige Schrödinger-ligningen i slutten av 1926, som er basert på det faktum at bølgefunksjoner oppfører seg som stående bølger.
Dette innebærer at bølgen ikke beveger seg, dens noder, det vil si dens likevektspunkter, tjener som en dreietap for resten av strukturen for å bevege seg rundt dem, og beskriver en bestemt frekvens og amplitude..
Schrödinger definerte bølgene som beskriver elektroner som stasjonære eller orbitale tilstander, og de er i sin tur assosiert med forskjellige energinivåer.
Den tidsuavhengige Schrödinger-ligningen er som følger:
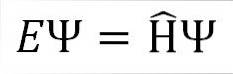
Hvor:
OG: konstant av proporsjonalitet.
Ψ: bølgefunksjonen til kvantesystemet.
Η ̂: Hamilton-operatør.
Den tidsuavhengige Schrödinger-ligningen brukes når det observerbare som representerer systemets totale energi, kjent som den Hamilton-operatøren, ikke er avhengig av tid. Funksjonen som beskriver den totale bølgebevegelsen vil imidlertid alltid avhenge av tid..
Schrödinger-ligningen indikerer at hvis vi har en bølgefunksjon Ψ, og den Hamilton-operatøren virker på den, representerer proporsjonalitetskonstanten E den totale energien til kvantesystemet i en av dets stasjonære tilstander.
Brukes på Schrödingers atommodell, hvis elektronen beveger seg i et definert rom, er det diskrete energiverdier, og hvis elektronen beveger seg fritt i rommet, er det kontinuerlige energiintervaller.
Fra matematisk synspunkt er det flere løsninger for Schrödinger-ligningen, hver løsning innebærer en annen verdi for proporsjonalitetskonstanten E.
I følge Heisenberg usikkerhetsprinsippet er det ikke mulig å estimere posisjonen og energien til et elektron. Derfor anerkjenner forskere at estimatet av plasseringen av elektronet i atomet er unøyaktig..
Postulater
Postulatene til Schrödingers atommodell er som følger:
-Elektroner oppfører seg som stående bølger som fordeles i rommet i henhold til bølgefunksjonen Ψ.
-Elektroner beveger seg inne i atom i orbitaler. Dette er områder der sannsynligheten for å finne et elektron er betydelig høyere. Den henviste sannsynligheten er proporsjonal med kvadratet til bølgefunksjonen Ψto.
Elektronkonfigurasjonen til Schrödinguer atommodell forklarer atoms periodiske egenskaper og bindingene de danner.
Imidlertid vurderer Schrödingers atommodell ikke spinn av elektroner, og heller ikke variasjoner i oppførselen til raske elektroner på grunn av relativistiske effekter..
Artikler av interesse
Atomic de Broglie-modellen.
Chadwick Atomic Model.
Heisenberg atommodell.
Perrins atommodell.
Thomsons atommodell.
Dalton atommodell.
Dirac Jordan atommodell.
Atomic model of Democritus.
Atomisk modell av Leucippus.
Bohr atommodell.
Sommerfeld atommodell.
Nåværende atommodell.
Referanser
- Schrodingers atommodell (2015). Gjenopprettet fra: quimicas.net
- Den kvantemekaniske modellen for atomet Gjenopprettet fra: en.khanacademy.org
- Schrödingers bølgeligning (s.f.). Jaime I. Castellón University, Spania. Gjenopprettet fra: uji.es
- Moderne atomteori: modeller (2007). © ABCTE. Gjenopprettet fra: abcte.org
- Schrodingers Atomic Model (s.f.). Gjenopprettet fra: erwinschrodingerbiography.weebly.com
- Wikipedia, The Free Encyclopedia (2018). Schrödinger ligning. Gjenopprettet fra: es.wikipedia.org
- Wikipedia, The Free Encyclopedia (2017). Youngs eksperiment. Gjenopprettet fra: es.wikipedia.org

Ingen har kommentert denne artikkelen ennå.