
Formler, egenskaper, bruksområder og risikoer av aluminiumnitrat
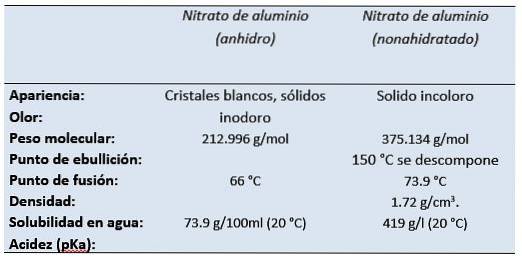
De aluminiumnitrat Det er aluminiumsaltet av salpetersyre. Aluminiumnitrat nonahydrat, ved romtemperatur, fremstår som et fargeløst fast stoff med lukten av salpetersyre..
De er ikke brennbare, men de kan akselerere forbrenningen av brennbare materialer. Hvis det er store mengder aluminiumnitrat involvert, eller hvis brennbart materiale er findelt, kan det oppstå en eksplosjon..

Langvarig eksponering for brann eller varme kan føre til en eksplosjon. Når de kommer i kontakt med ild, produserer de nitrogenoksider. Dens bruksområder inkluderer raffinering av petroleum, og farging og garvning av lær..
Det er et hvitt, vannløselig salt som oftest forekommer i sin krystallinske nonahydratform (aluminiumnitrat nonahydrat)..
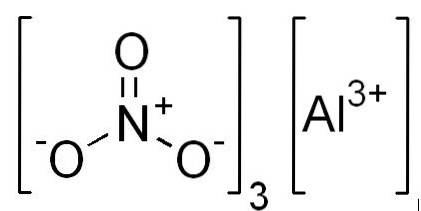
Artikkelindeks
- 1 Formler
- 2 Struktur
- 2.1 I 2D
- 2.2 I 3D
- 3 Fysiske og kjemiske egenskaper
- 3.1 Reaktivitetsvarsler
- 3.2 Reaksjoner med luft og vann
- 3.3 Brennbarhet
- 3.4 Reaktivitet
- 3.5 Toksisitet
- 4 bruksområder
- 5 Kliniske effekter
- 6 Sikkerhet og risiko
- 6.1 GHS fareklasser
- 6.2 Sikkerhetskoder
- 7 Referanser
Formler
- Aluminiumnitrat: Al (NO3)3
- Aluminiumnitrat nonahydrat: Al (NO3)3 9HtoELLER
- CAS: 13473-90-0 Aluminiumnitrat (vannfritt)
- CAS: 14797-65-0 Aluminiumnitrat (ikke-hydrat)
Struktur
I 2D
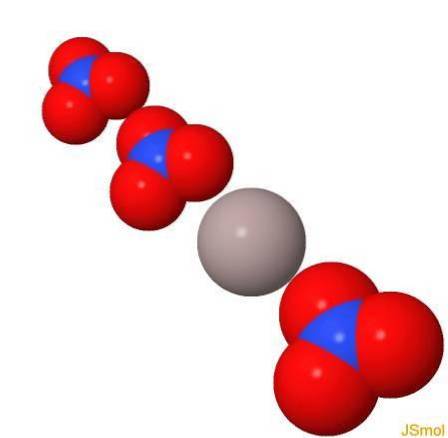
I 3d
Fysiske og kjemiske egenskaper
- Aluminiumnitrat tilhører den reaktive gruppen av uorganiske nitrat- og nitrittforbindelser.
- Nitrationet er et polyatomisk ion med molekylformelen NO3 - og er den konjugerte basen av salpetersyre.
- Nesten alle uorganiske nitratsalter er oppløselige i vann ved standard temperatur og trykk..
- Nitratforbindelser har et bredt spekter av bruksområder basert på deres aktivitet som oksidasjonsmidler, tilstedeværelsen av fritt tilgjengelig nitrogen eller deres høye løselighet..
Reaktivitetsvarsler
Aluminiumnitrat er et sterkt oksidasjonsmiddel.
Reaksjoner med luft og vann
Aluminiumnitrat er lekker (det har den egenskapen at det absorberer fuktighet fra luften for å danne en vandig løsning). Det er løselig i vann. De vandige løsningene er sure.
Brennbarhet
Nitrater og nitritter er eksplosive forbindelser. Noen av disse stoffene kan spres eksplosivt når de blir oppvarmet eller involvert i en brann. De kan eksplodere fra varme eller forurensning. Beholdere kan eksplodere ved oppvarming.
Spesielle farer ved forbrenningsprodukter: giftige nitrogenoksider kan dannes i en brann som involverer aluminiumnitrat.
Reaktivitet
Nitrater og nitritter kan virke som ekstremt kraftige oksidasjonsmidler, og blandinger med reduksjonsmidler eller reduserte materialer som organiske stoffer kan være eksplosive. Reager med syrer for å danne giftig nitrogendioksid.
Generelt er nitrat- og nitritsalter med redoksaktive kationer (overgangsmetaller og metallene i gruppe 3a, 4a og 5a i det periodiske systemet, samt ammoniumkation [NH4] +) mer reaktive med organiske materialer og midler. i omgivelsesforhold.
Aluminiumnitrat er et oksidasjonsmiddel. Blandinger med alkylestere kan eksplodere. Blandinger med fosfor, tinn (II) klorid eller andre reduksjonsmidler kan reagere eksplosivt.
Toksisitet
Mennesker er utsatt for nitrat- og nitrittoksisitet, og barn er spesielt utsatt for metemoglobinemi.
Svelging av store doser aluminiumnitrat forårsaker mageirritasjon, kvalme, oppkast og diaré. Kontakt med støv irriterer øynene og huden.
applikasjoner
Nitrater og nitritter er mye brukt (og i svært store mengder) som gjødsel i jordbruket på grunn av deres vilje til å bryte ned og frigjøre nitrogen for plantevekst og på grunn av deres løselighet, som gjør at nitrationer kan absorberes av plantens røtter.
Nitratforbindelser brukes også mye som et industrielt råmateriale når et oksidasjonsmiddel eller nitrationkilde er nødvendig..
Aluminiumnitrat brukes til fremstilling av kjemikalier for laboratorium, kosmetikk og personlig hygiene. I industrien brukes det som et mellomprodukt i produksjonen av andre stoffer.
Det brukes i garvning av skinn, i antiperspiranter, korrosjonshemmere, i uranekstraksjon, petroleumsraffinering og som et nitreringsmiddel..
Aluminiumnitrat nonahydrat og andre hydratiserte aluminiumnitrater har mange bruksområder. Disse saltene brukes til å produsere aluminiumoksyd for fremstilling av isolasjonspapir, i varmeelementer av katodestrålerør og i kjernelaminatene til transformatorer. Hydrerte salter brukes også til ekstraksjon av aktinide elementer.
Kliniske effekter
Aluminium er allestedsnærværende, det er det mest vanlige metallet i jordskorpen. Mest menneskelig eksponering kommer fra mat. Det finnes i noen farmasøytiske produkter. I industrien er det mye brukt.
Aluminium hemmer beinomdannelse og forårsaker osteomalasi. Det antas å hemme erytropoies, forårsaker anemi.
Akutt forgiftning er sjelden. Løselige former av aluminium har større potensial for toksisitet enn uoppløselige former på grunn av deres større absorpsjon..
Pasienter med nyresvikt er utsatt for aluminiumtoksisitet, enten fra aluminium i dialysatet eller andre eksogene kilder, spesielt fosfatbindere og antacida inneholdende aluminium..
Kronisk eksponering for aluminiumstøv kan forårsake dyspné, hoste, lungefibrose, pneumothorax, pneumokoniose, encefalopati, svakhet, inkoordinering og epileptiforme anfall..
Aluminiumssalter kan forårsake irritasjon av øyne og slimhinner, konjunktivitt, dermatose og eksem..
Selv om aluminium og dets forbindelser har vist lite bevis på kreftfremkallende egenskaper hos mennesker, har eksponering for andre stoffer som er involvert i aluminiumsproduksjon vært assosiert med kreftfremkallende egenskaper..
Sikkerhet og risiko
Faresetninger fra det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (GHS).
Det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (GHS) er et internasjonalt avtalt system, laget av FN og designet for å erstatte de forskjellige klassifiserings- og merkingsstandardene som brukes i forskjellige land ved å bruke konsistente kriterier globalt..
Fareklassene (og deres tilsvarende kapittel i GHS), klassifiserings- og merkestandardene og anbefalingene for aluminiumnitrat og for aluminiumnitrat-nonahydrat er som følger (European Chemicals Agency, 2017; FN, 2015; PubChem, 2017):
GHS-fareklasser
H272: Kan forsterke brannen; Oxidizer [Advarsel Oksiderende væsker; Oksiderende faste stoffer - Kategori 3] (PubChem, 2017).
H301: Giftig ved svelging [Fare for akutt toksisitet, oral - kategori 3] (PubChem, 2017).
H315: Forårsaker hudirritasjon [Advarsel Hudetsing / irritasjon - Kategori 2] (PubChem, 2017).
H318: Gir alvorlig øyeskade [Fare Alvorlig øyeskade / øyeirritasjon - Kategori 1] (PubChem, 2017).
H319: Gir alvorlig øyeirritasjon [Advarsel Alvorlig øyeskade / øyeirritasjon - Kategori 2A] (PubChem, 2017).
Sikkerhetskoder
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P405, og (PubChem, 2017).





Referanser
- ChemIDplus (2017) 3D-struktur av 13473-90-0 - Aluminiumnitrat [image] Gjenopprettet fra: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-struktur av 7784-27-2 - Aluminiumnitrat nonahydrat [image] Gjenopprettet fra: chem.nlm.nih.gov.
- Daisa, J. (2017) Shell Oil Refinery at Dusk [image] Gjenopprettet fra: flickr.com.
- Edgar181 (2008) Aluminiumnitrat [bilde]. Gjenopprettet fra: wikipedia.org.
- European Chemicals Agency (ECHA). (2016). Aluminiumnitrat. Kort profil. Hentet 8. februar 2017 fra echa.europa.eu.
- Databank for farlige stoffer (HSDB). TOXNET. (2017). Aluminiumnitrat. Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: chem.nlm.nih.gov.
- JSmol (2017) Nitrat [bilde] Gjenopprettet fra: chemapps.stolaf.edu.
- Wikipedia. (2017). Aluminiumnitrat. Hentet 8. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Aluminiumnitrat nonahydrat. Hentet 8. februar 2017 fra: wikipedia.org.



Ingen har kommentert denne artikkelen ennå.