
Hva er det periodiske systemet til? 7 Viktige bruksområder

De periodiske tabell Det tjener til å vise forholdet mellom de forskjellige elementene; Den kan også brukes til å forutsi egenskapene til nye elementer som ennå er oppdaget eller ennå ikke er syntetisert..
Den gir informasjon og data om gruppene, elementene, atommassen, ioniseringsenergien, elektronisk konfigurasjon, atomnummer, elektronegativitet og oksidasjonstilstander. Det periodiske systemet gir også et nyttig rammeverk for å analysere kjemisk atferd; Det er mye brukt innen kjemi og i mange andre vitenskaper.
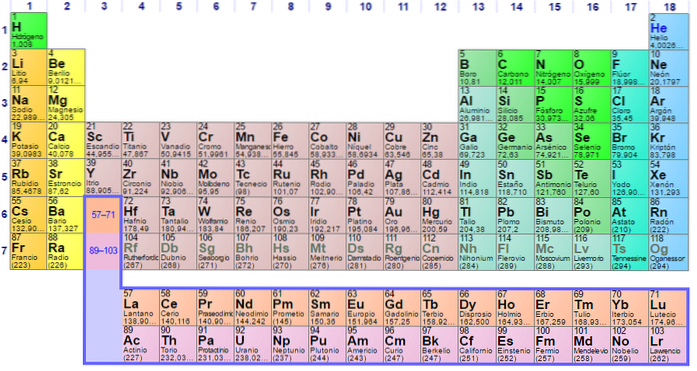
Den ble bygget i 1869 av den russiske forskeren Dmitri Ivanovich Mendeleev for å visualisere de forskjellige forholdene mellom de forskjellige kjemiske elementene..
Det periodiske systemet er ordnet etter atomnummer, elektronkonfigurasjoner og tilbakevendende kjemiske egenskaper. Det er også ordnet slik at gjenstander med lignende oppførsel er i samme kolonne.
Tabellen har fire rektangulære blokker med lignende kjemiske egenskaper. Vanligvis er elementene på venstre side av en rad metaller, og ikke-metallene er til høyre.
Elementene er plassert på det periodiske systemet basert på deres atomstruktur. Hver rad og hver kolonne har spesielle egenskaper.
Alle radene i tabellen blir lest fra venstre til høyre, og hver rad blir referert til som en periode. Hver kolonne i tabellen kalles en gruppe. Hver gruppe i tabellen har samme antall elektroner.
Det er lett å finne antall elektroner i det ytre skallet til hvert element i tabellen. Gruppe en har ett elektron, gruppe to har to, og så videre.
En god periodisk tabell er et flott verktøy for problemløsning i kjemi. Periodiske tabeller finnes på nettet, eller de kan skrives ut.
Bruk av det periodiske systemet hva er det til?
Kjenn symbolet til det kjemiske elementet
Symboler er stenografi for varens navn. I mange tilfeller kommer forkortelsen fra det opprinnelige latinske navnet.
Hvert symbol har en eller to bokstaver som en forkortelse. Vanligvis er symbolet en forkortelse av navnet på elementet, men noen symboler refererer til de gamle navnene på elementene.
Et eksempel på denne saken er sølv; dets symbol er Ag, som refererer til det gamle navnet som var argentum.
Kjenn atomnummeret til elementet
Dette er antall protoner som et atom av dette elementet inneholder. Antall protoner er den avgjørende faktoren når det gjelder å skille ett element fra et annet. Variasjonen i antall elektroner eller nøytroner endrer ikke typen element.
Endrende antall elektroner produserer ioner, mens endringer i antall nøytroner produserer isotoper. Det moderne periodiske systemet er ordnet i stigende rekkefølge av atomnummer.
Identifiser hva periodene og gruppene i periodisk tabell betyr
De horisontale radene kalles perioder. Hver periode indikerer det høyeste energinivået som hvert av elektronene til det elementet opptar i sin basistilstand..
De vertikale kolonnene kalles grupper. Hvert element i en gruppe har samme valenselektronnummer, og de oppfører seg vanligvis på en lignende måte når de er relatert til andre elementer..
De to siste radene, lantanidene og aktinidene, tilhører gruppe 3B og er oppført separat..
Kjenn navnet på elementet
Mange periodiske tabeller inkluderer også hele navnet på varen. Dette er nyttig når det gjelder å kjenne et element siden du ikke alltid kan huske symbolene til alle elementene.
Bli kjent med atommassen til elementet i atommasseenheter
Dette tallet refererer til den gjennomsnittlige tunge massen til isotopene til et kjemisk element. Mendeleevs opprinnelige periodiske tabell var organisert slik at elementene ble vist i stigende rekkefølge av atommasse eller vekt..
Identifiser elementtypene
Mange periodiske tabeller identifiserer forskjellige typer elementer ved å bruke forskjellige farger for forskjellige typer elementer.
Disse typene inkluderer alkalimetaller, uedle metaller, overgangsmetaller, ikke-metaller, edelgasser, allogener, jordalkalier, halvmetaller, aktinider og lantanider..
Vis de forskjellige trendene (periodisitet)
Det periodiske systemet er organisert for å vise de forskjellige typene trend (periodisitet). Mellom dem:
- Atomradiusen, som er halvparten av avstanden mellom sentrene til to atomer som knapt berører hverandre:
- Det øker når du beveger deg fra toppen til bunnen av det periodiske systemet.
- Den synker når den beveger seg fra venstre til høyre gjennom det periodiske systemet.
- Ioniseringsenergi, som er energien som kreves for å fjerne et elektron fra atomet.
- Den synker når den beveger seg opp og ned i det periodiske systemet.
- Øker når du beveger deg fra venstre til høyre på det periodiske systemet.
- Elektronegativitet, som måler evnen til å danne en kjemisk binding.
- Den går ned når den beveger seg opp og ned.
- Øker når du beveger deg fra venstre til høyre.
- Elektronaffinitet, som refererer til elementets evne til å akseptere et elektron.
Elektronaffinitet kan forutsies basert på gruppene av elementene. Edelgasser, som argon og neon, har nesten null elektronaffinitet og har ikke en tendens til å akseptere elektroner..
Halogener, som klor og jod, har høye elektronaffiniteter. De fleste andre grupper av elementer har elektronaffiniteter lavere enn for allogener, men mye høyere enn for edelgasser..
Referanser
- Hva er hensikten med det periodiske systemet? Gjenopprettet fra reference.com
- Hvordan bruke en periodisk tabell (2017) Gjenopprettet fra thoughtco.com
- Hvordan er elementene i det periodiske systemet organisert? Gjenopprettet fra reference.com
- Periodiske tabell. Gjenopprettet fra wikipeda.org
- Hvorfor er det periodiske systemet nyttig. Gjenopprettet fra reference.com

Ingen har kommentert denne artikkelen ennå.