
Transamineringsmekanisme, funksjon og eksempler
De transaminering er en type kjemisk reaksjon som fungerer i "omfordeling" av aminogrupper mellom aminosyrer, siden den involverer reversible amineringsprosesser (tilsetning av en aminogruppe) og deaminering (eliminering av en aminogruppe), som katalyseres av spesifikke enzymer som er kjent som transaminaser eller aminotransferaser.
Den generelle transamineringsreaksjonen involverer utveksling mellom en aminosyre og hvilken som helst a-ketosyre, hvor utvekslingen av en aminogruppe gir keto-syreversjonen av den første substrataminosyren og aminosyreversjonen av det første substratet α-ketosyre..

Aminogruppen som vanligvis byttes ut er "alfa" amino, det vil si den som deltar i dannelsen av peptidbindinger og som definerer strukturen til aminosyrer, selv om reaksjoner som involverer andre aminogrupper som er tilstede i forskjellige posisjoner, også kan forekomme..
Med unntak av lysin, treonin, prolin og hydroksyprolin, deltar alle aminosyrer i transaminasjonsreaksjoner, selv om transaminaser er beskrevet for histidin, serin, metionin og fenylalanin, men deres metabolske veier involverer ikke denne typen reaksjoner..
Transamineringsreaksjonene mellom aminosyrer og α-ketosyrer ble oppdaget i 1937 av Braunstein og Kritzmann, og siden den gang har de vært gjenstand for intensive studier, siden de forekommer i mange vev av forskjellige organismer og med forskjellige formål..
Hos mennesker er transaminaser for eksempel vidt distribuert i kroppsvev og er spesielt aktive i hjertemuskelvev, lever, skjelettmuskulatur og nyrer..
Artikkelindeks
- 1 Reaksjonsmekanisme
- 2 Funksjon for transaminering
- 3 eksempler
- 4 Referanser
Reaksjonsmekanisme
Transamineringsreaksjoner involverer mer eller mindre den samme mekanismen. Som diskutert ovenfor forekommer disse reaksjonene som en reversibel utveksling av en aminogruppe mellom en aminosyre og en a-ketosyre (deaminert), og produserer a-ketosyren i donoraminosyren og aminosyren til a-ketosyren. reseptor..
Disse reaksjonene avhenger av en forbindelse kjent som pyridoxal fosfat, et derivat av vitamin B6 som deltar som en transportør av aminogrupper og som binder seg til transaminaseenzymer gjennom dannelsen av en Schiff-base mellom aldehydgruppen i dette molekylet. Og ε-amino av en lysinrest i det aktive stedet for enzymet.
Bindingen mellom pyridoksalfosfat og lysinresten i det aktive stedet er ikke kovalent, men skjer gjennom den elektrostatiske interaksjonen mellom den positive ladningen av nitrogen på lysin og den negative ladningen på fosfatgruppen av pyridoksal.
I løpet av reaksjonen fortrenger aminosyren som fungerer som et substrat ε-aminogruppen i lysinresten i det aktive stedet som deltar i Schiff-basen med pyridoksal.
I mellomtiden fjernes et par elektroner fra aminosyrens alfa-karbon og overføres til pyridinringen som utgjør pyridoksalfosfat (positivt ladet) og deretter "leveres" til α-ketosyren som fungerer som et andre substrat..
På denne måten deltar pyridoksalfosfat ikke bare i overføring eller transport av aminogrupper mellom aminosyrer og α-keto-syrer som er substrater for transaminaser, men fungerer også som en "synke" av elektroner, noe som letter dissosiasjonen av alfa-aminosyrehydrogenet..
Oppsummert overfører det første substratet, en aminosyre, sin aminogruppe til pyridoksal fosfat, hvorfra det deretter overføres til det andre substratet, en α-ketosyre, som i mellomtiden danner en mellomforbindelse kjent som pyridoksaminfosfat..
Transamineringens funksjon
Transaminaseenzymer finnes vanligvis i cytosol og mitokondrier og fungerer i integrasjonen av forskjellige metabolske veier.
Glutamatdehydrogenase i omvendt reaksjon kan for eksempel omdanne glutamat til ammonium, NADH (eller NADPH) og α-ketoglutarat, som kan komme inn i trikarboksylsyresyklusen og fungere i energiproduksjon.
Dette enzymet, som er i mitokondrie-matrisen, representerer et forgreningspunkt som forbinder aminosyrer med energimetabolisme, slik at når en celle mangler nok energi i form av karbohydrater eller fett til å fungere, kan den alternativt bruke noen aminosyrer til det samme hensikt.
Dannelsen av enzymet (glutamatdehydrogenase) under hjernens utvikling er viktig for kontrollen av ammoniumavgiftning, siden det har vist seg at noen tilfeller av mental retardasjon har å gjøre med en lav aktivitet av dette, noe som fører til ammoniumoppbygging, som er skadelig for hjernens helse.
I noen leverceller kan transaminasjonsreaksjoner også brukes til syntese av glukose ved glukoneogenese.
Glutamin omdannes til glutamat og ammonium av enzymet glutaminase. Glutamat blir deretter omdannet til α-ketoglutarat, som går inn i Krebs-syklusen og deretter glukoneogenese. Dette siste trinnet skjer takket være at malat, et av produktene på ruten, transporteres ut av mitokondriene ved hjelp av en skyttelbuss..
Denne skyssen etterlater α-ketoglutarat etter det malic enzymet, som omdanner det til pyruvat. To pyruvatmolekyler kan deretter omdannes til ett glukosemolekyl gjennom glukoneogenese..
Eksempler
De vanligste transaminasjonsreaksjonene er relatert til aminosyrene alanin, glutaminsyre og asparaginsyre..
Noen aminotransferaseenzymer kan, i tillegg til pyridoksalfosfat, bruke pyruvat som et "koenzym", slik som glutamat-pyruvat-transaminase, som katalyserer følgende reaksjon:
glutamat + pyruvat ↔ alanin + α-ketoglutarat
Muskelceller er avhengige av denne reaksjonen for å produsere alanin fra pyruvat og for energi gjennom Krebs-syklusen via α-ketoglutarat. I disse cellene avhenger bruken av alanin som energikilde av eliminering av aminogrupper som ammoniumioner i leveren gjennom urea-syklusen..
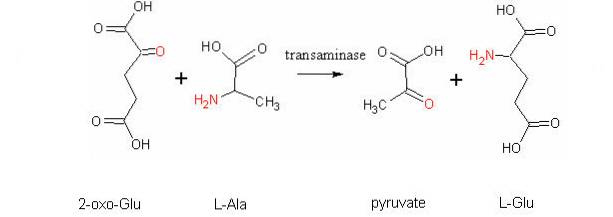
En annen veldig viktig transaminasjonsreaksjon hos forskjellige arter er den som katalyseres av enzymet aspartataminotransferase:
L-aspartat + α-ketoglutarat ↔ oksaloacetat + L-glutamat
Sist men ikke minst, transamineringsreaksjonen av γ-aminosmørsyre (GABA), en ikke-proteinaminosyre som er essensiell for sentralnervesystemet som fungerer som en hemmende nevrotransmitter. Reaksjonen katalyseres av en y-aminosmørsyre-transaminase og er omtrent som følger:
α-ketoglutarat + 4-aminobutansyre ↔ Glutamat + Succinic semialdehyd
Succinic semialdehyd omdannes til succinic acid gjennom en oksidasjonsreaksjon, og sistnevnte kan gå inn i Krebs-syklusen for energiproduksjon.
Referanser
- Bhagavan, N. V., & Ha, C. E. (2002). Protein og aminosyre metabolisme. Medisinsk biokjemi (4. utgave), Academic Press: San Diego, CA, USA, 331.
- Cammarata, P. S. og Cohen, P. P. (1950). Omfanget av transaminasjonsreaksjonen i dyrevev. Journal of Biological Chemistry, 187, 439-452.
- Ha, C. E., & Bhagavan, N. V. (2011). Essentials of medical biochemistry: med kliniske tilfeller. Akademisk presse.
- Litwack, G. (2017). Human biokjemi. Akademisk presse.
- Rowsell, E. V. (1956). Transaminasjoner med pyruvat og andre α-ketosyrer. Biochemical Journal, 64 (2), 246.
- Snell, E. E., & Jenkins, W. T. (1959). Mekanismen for transaminasjonsreaksjonen. Journal of cellular and comparative physiology, 54 (S1), 161-177.



Ingen har kommentert denne artikkelen ennå.