
Hydrogenperoksid (H2O2) struktur, egenskaper, bruksområder, produksjon
De hydrogenperoksid er en uorganisk forbindelse hvis kjemiske formel er HtoELLERto. Av alt er det det enkleste peroksidet i denne familien av kjemiske forbindelser. Dens strukturformel er H-O-O-H, som er denne interne oksygenerte brokarakteristikken for alle peroksider.
I 1818 ble HtoELLERto Det ble identifisert av Louies Jacques Thénard, som forberedte en kjemisk forbindelse som han kalte hydrogenperoksid på den tiden. Det er en ustabil forbindelse, den spaltes ved eksponering for lys, varme og noen metaller.
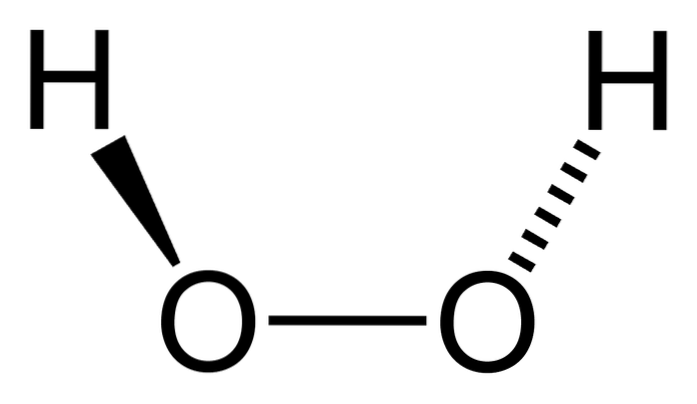
Det er en veldig nyttig forbindelse som brukes til desinfisering av mindre sår, hårbleking, vannbehandling, etc. Selv om det kan ha skadelige handlinger for mennesker, finnes det i alle eukaryote celler hos levende vesener, der det utfører flere fordelaktige funksjoner.
Hydrogenperoksid produserer oksidasjon av giftige stoffer som fenoler, etanol, formaldehyd, etc., produkter som elimineres av lever og nyrer. I tillegg bidrar det til ødeleggelse av bakterier fagocytosert av nøytrofile leukocytter og makrofager..
Artikkelindeks
- 1 Struktur
- 1.1 Molekyl
- 1.2 Rotasjoner
- 1.3 Intermolekylære interaksjoner
- 2 eiendommer
- 2.1 Navn
- 2.2 Molarmasse
- 2.3 Fysisk utseende
- 2.4 Lukt
- 2.5 Smak
- 2.6 Tetthet
- 2.7 Smeltepunkt
- 2.8 Kokepunkt
- 2.9 Løselighet i vann
- 2.10 Løselighet
- 2.11 Fordelingskoeffisient for oktanol / vann
- 2.12 Damptrykk
- 2.13 Dissosiasjonskonstant
- 2,14 pH
- 2.15 Brytningsindeks (nD)
- 2.16 Viskositet
- 2.17 Varmekapasitet
- 2.18 Fordampningsvarme
- 2.19 Stabilitet
- 2.20 Korrosjon
- 2.21 Nedbrytning
- 2.22 Overflatespenning
- 2.23 Reaktivitet
- 3 bruksområder
- 3.1 Bleking
- 3.2 Desinfeksjonsmiddel
- 3.3 Vaskemiddel
- 3.4 Kosmetisk applikasjon
- 3.5 Drivmiddel
- 4 Motta
- 4.1 Hydrogenering
- 4.2 Filtrering
- 4.3 oksidasjon
- 4.4 Ekstraksjon og rensing
- 5 risikoer
- 6 Referanser
Struktur
Molekyl
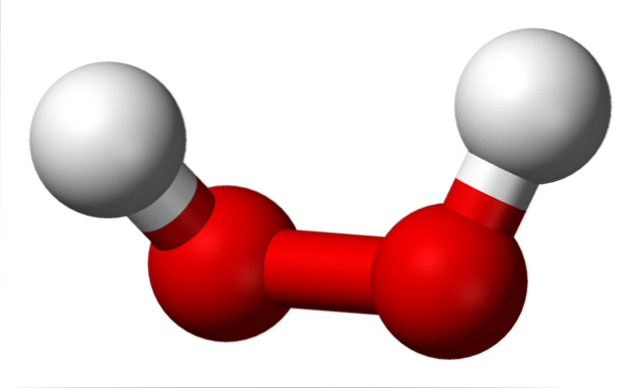
Det øvre bildet viser strukturen til H-molekylettoELLERto (H-O-O-H), med de røde kulene som tilsvarer oksygenatomene, og de hvite hydrogenatomene. Merk at molekylet ikke er flatt, og at H-atomene ikke er formørket i rommet (det ene foran det andre).
Interessant, til HtoELLERto Det er vanskelig for den å rotere sin sentrale enkle O-O-binding, så posisjonene til disse H-ene kan ikke byttes ut; den ene vil ikke gå ned mens den andre går opp.
Hvorfor? Fordi det i de to oksygenatomene er to ledige elektronpar, noe som gir totalt åtte veldig tette elektroner som frastøter hverandre på grunn av deres negative ladninger..
Rotasjoner
Allikevel er O-O-bindingen utsatt for liten rotasjon på grunn av interaksjoner med omgivelsene..
For eksempel, ved å bringe de to tommelen sammen, med pekefingrene strukket og de andre lukket, som om du tegner en bane, og deretter vri tommelen på en slik måte at en av pekefingrene peker fremover og den andre har en omtrentlig representasjon av HtoELLERto.
Hvis en kropp berører en av pekefingrene, vil tommelen rotere som svar på denne interaksjonen; de vil imidlertid umiddelbart gå tilbake til sin opprinnelige stilling på grunn av de elektroniske frastøtelsene nevnt ovenfor. Disse rotasjonene rammer dermed de dynamiske aspektene av dette molekylet.
Intermolekylære interaksjoner
I flytende tilstand er HtoELLERto klarer å etablere hydrogenbindinger (HOOH-OtoHto), ellers ville ikke det høye kokepunktet (150 ºC) sammenlignet med vann bli forklart.
Når den går over i gassfasen, H-molekylenetoELLERto antagelig kan den ikke lenger danne slike broer, ikke bare på grunn av den større intermolekylære avstanden, men også hydrogenatomene vil være de første som berører i tilfelle kollisjoner (dette kan visualiseres ved å ty til fingermodellen igjen).
I mellomtiden, i den faste fasen, er vinkelen på flyene som ble etablert av H 90 ° (sett pekefingrene vinkelrett). Nå blir hydrogenbindinger enda viktigere og H-molekylertoELLERto er anordnet i en krystall med tetragonal struktur.
Eiendommer
sFlaske med hydrogenperoksid. På apotek oppnås det med en konsentrasjon på 3% m / v. Kilde: Pixnio.
Navn
-Hydrogenperoksid
-Antioksid
-Oksidanol
-Perhydroksinsyre
-O-hydroksyol
-Peroksid
Molarmasse
34,0147 g / mol
Fysisk utseende
Lyseblå (konsentrert) eller fargeløs væske. Den er litt mer tyktflytende og tettere enn vann. Den destilleres for sikkerhet ved lave temperaturer og under redusert trykk, siden den brytes ned ved oppvarming i eksplosiv form.
Lukt
Skarp eller en ozonlignende lukt.
Smak
Bitter
Tetthet
Massiv 1,71 g / cm3
Tettheten av de vandige løsningene avhenger av konsentrasjonen; for eksempel ved 27% har den en tetthet på 1,10 g / cm3, mens den var på 50%, 1,13 g / cm3
Smeltepunkt
- 0,43 ºC
Kokepunkt
150,2 ° C Denne verdien er oppnådd ved ekstrapolering, siden hydrogenperoksid brytes ned ved høye temperaturer.
Vannløselighet
Blandbar ≥ 100 mg / ml ved 25 ºC
Løselighet
Den er løselig i eter og alkoholer, men uoppløselig i petroleumeter. Nedbrytes til vann og oksygen i mange organiske løsningsmidler.
Fordelingskoeffisient for oktanol / vann
Logg P = - 0,43
Damptrykk
5 mmHg ved 30 ºC.
Dissosiasjonskonstant
pKa = 11,72
pH
Hydrogenperoksidløsninger er litt sure. For eksempel har en 35% en en pH på 4,6; men ved å konsentrere seg til 90% blir pH mindre sur: 5.1.
Brytningsindeks (nD)
1.4061
Viskositet
1245 cPoise ved 20 ºC.
Varmekapasitet
1267 J / gK (gass)
2619 J / gK (væske)
Fordampningsvarme
1.519 J / gK
Stabilitet
Stabil under anbefalte forhold. Det stabiliseres ytterligere ved tilsetning av acetanilid og tinnsalter.
Korrosjon
Etsende
Nedbrytning
Den spaltes ved eksponering for lys eller i nærvær av oksiderende og reduserende stoffer. Det nedbrytes også ved oppvarming. Når den spaltes, frigjør den vann og oksygen, og favoriseres av en økning i pH og temperatur, samt av tilstedeværelsen av enzymkatalasen..
Overflatespenning
80,4 dyn / cm ved 20 ° C
Reaktivitet
HtoELLERto Det fungerer som et oksidasjonsmiddel i sure oppløsninger av jernholdig jern (Feto+) til jernjern (F3+); oksyderer også sulfittionen (SO3to-) til sulfation (SO4to-).
Det kan også fungere som et reduksjonsmiddel i nærvær av basiske løsninger, redusere natriumhypokloritt (NaOCl) og kaliumpermanganat (KMnO4) med frigjøring av oksygen.
applikasjoner
Whitening
Hydrogenperoksid brukes i papirindustrien i masse og papirbleking, som bruker mesteparten av den årlige produksjonen.
Desinfeksjonsmiddel
Hydrogenperoksid er et mildt antiseptisk middel for å forhindre infeksjon av små sår, skraper og forbrenninger. Det brukes også som munnvann og for å lindre mild irritasjon i munnen på grunn av tilstedeværelsen av kreftsår eller tannkjøttbetennelse..
Det brukes også til å desinfisere overflater, det indre av kjøleskap, vann og bekjempe overdreven bakterievekst i vannsystemer og kjøletårn. Hydrogenperoksid frigjør frie oksygenradikaler, som bryter ned forurensninger.
Vaskemiddel
Hydrogenperoksid brukes til fremstilling av vaskeblandingsvaskemidler, inkludert natriumperkarbonat. Denne forbindelsen er et kompleks av natriumkarbonat og hydrogenperoksid som, når det er oppløst i vann, skilles ut i komponentene.
Kosmetisk applikasjon
Fortynnet hydrogenperoksid brukes i hårbleking før farging. Det brukes også til å bleke tennene, så vel som en del av en hjemmelaget tannkrem.
Drivmiddel
Hydrogenperoksid brukes som monopropellant eller oksiderende komponent i en bipropolent rakett. Den nedbryter frigjøring av oksygen og vann, et kjennetegn som tillot bruk som drivmiddel.
Den pumpes inn i en reaksjonscelle med nærvær av en katalysator som akselererer nedbrytningen. I løpet av dette produseres en vanndamp med høy temperatur.
Når dampen drives ut gjennom et gap, produserer den en impuls. Ubåten V-80, bygget i 1940, brukte oksygen generert fra hydrogenperoksid i turbinene; kalte Walters turbinesystem.
Å skaffe
Opprinnelig ble hydrogenperoksyd oppnådd industrielt ved hydrolyse av ammoniumpersulfat, [(NH4)toStoELLER8] eller elektrolyse av ammoniumbisulfat, NH4HSO4.
Hydrogenperoksid oppnås for tiden industrielt ved bruk av antrakinon. Prosessen utføres i fire trinn: hydrogenering, filtrering, oksidasjon, ekstraksjon og rensing..
Hydrogenering
Alkylantrokinon hydrogeneres ved å føre hydrogengass gjennom en hydrogenator fylt med aluminiumoksyd og en liten mengde katalysator (palladium). Temperaturen holdes på 45 ºC under permanent omrøring.
Alkyldroquinon omdannes til alkylantrahydrokinon og tetrahydroalkylantrahydrokinon, sistnevnte blir valgt for sin større bekvemmelighet for de følgende prosedyrer.
Filtrering
Løsningen som inneholder det hydrogenerte antrakinonet filtreres for å fjerne spor av katalysatoren som den kan inneholde..
Oksidasjon
Den filtrerte løsningen oksyderes ved å føre luft gjennom den og danner hydrogenperoksid med lav renhet..
Ekstraksjon og rensing
Løsningen med hydrogenperoksyd passerer gjennom en væske-væske-ekstraksjonskolonne. Vannet strømmer gjennom kolonnen, mens løsningen med hydrogenperoksyd pumpes gjennom den.
Vannet når bunnen av ekstraktoren med en hydrogenperoksydkonsentrasjon mellom 25 og 35% vekt / vekt. Deretter renses den ved vakuumdestillasjon til en hydrogenperoksydkonsentrasjon på 30%. Endelig stabiliserer og lagrer.
Risiko
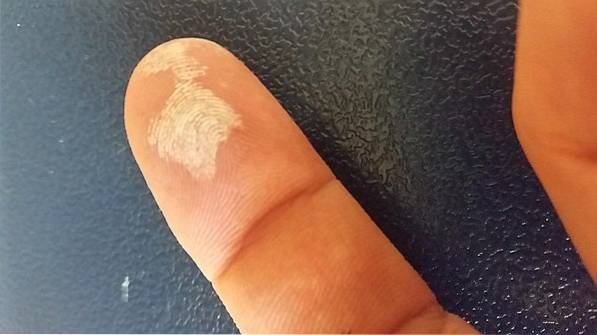
Hydrogenperoksid er et etsende middel, så det forårsaker alvorlig irritasjon ved kontakt med huden, samt en midlertidig bleking (bildet ovenfor). Det kan også forårsake øyeskade, kløe, utslett, rødhet og blemmer..
Innånding forårsaker irritasjon i nese, hals og lunger. I mellomtiden kan gjentatt eksponering forårsake bronkitt, hoste, slim og kortpustethet. Og som om det ikke var nok, genererer det også hodepine, svimmelhet, kvalme og oppkast.
Alvorlig eksponering for hydrogenperoksid kan føre til at væske samler seg i lungene, kjent som lungeødem - en alvorlig tilstand som krever øyeblikkelig legehjelp..
Occupational Safety and Health Administration (OSHA) har etablert maksimum tillatt for hydrogenperoksid på 1 ppm i et arbeidsmiljø i en 8-timers skift. Imidlertid, siden det er en mutagent forbindelse, bør eksponeringen holdes på et minimum..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Hydrogenperoksid. Gjenopprettet fra: en.wikipedia.org
- William R. Busing og Henri A. Levy. (2004). Krystall og molekylær struktur av hydrogenperoksid: En nøytrondiffraksjonsstudie. doi.org/10.1063/1.1696379
- Nasjonalt senter for bioteknologisk informasjon. (2019). Hydrogenperoksid. PubChem-database. CID = 784. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Redaksjonen av Encyclopaedia Britannica. (27. november 2018). Hydrogenperoksid. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- New Jersey Department of Health. (2016). Hydrogenperoksid. [PDF]. Gjenopprettet fra: nj.gov
- Mathews, C. K., Van Holde, K. E., Ahern, K. G. (2002). Biokjemi. Tredje utgave. Utgiver Pearson Addison Wesley
- Web MD. (2019). Hydrogenperoksid. Gjenopprettet fra: webmd.com



Ingen har kommentert denne artikkelen ennå.